大B细胞淋巴瘤治疗新纪元:2025年的进展比我们想象得更快
对于大B细胞淋巴瘤(LBCL)患者和医生而言,过去十年治疗格局的变化已足够令人惊叹,而2025的进展速度更像是按下了“快进键”。抗体偶联药物(ADC)、双特异性抗体(BsAb)、CAR-T、小分子药物……
每一类治疗方式不仅迎来了临床突破,更重要的是:它们开始真正形成可选择、可替代、可互补的系统生态。这意味着更多患者能获得“合适的治疗”,而不是“唯一的治疗”。下面介绍2025年一些重要的研究、进展与趋势。
01|ADC——精准“生物导弹”
正在改变LBCL的治疗节奏
相比传统化疗,ADC最大的特点是:
精准递送毒素,但保护正常组织
适合与免疫药物联用,毒性不叠加
治疗流程逐渐“门诊化”
2025 年,几项关键研究让 ADC 的未来更明朗,也更值得期待。

2025年ADC研究进展一览
抗-CD79b ADC:Polatuzumab vedotin(Polivy)——一个“改变治疗方式”的组合诞生
罗氏制药于2025年6月20日公布的关键III期SUNMO研究数据[1-2]显示,莫妥珠单抗(mosunetuzumab)与Polivy联合治疗方案在治疗不适合移植的复发性或难治性(R/R)LBCL患者中,展现出显著优于传统化疗方案R-GemOx(利妥昔单抗+吉西他滨+奥沙利铂组成)的疗效与安全性。
联合治疗组中位无进展生存期(PFS)达11.5个月(R-GemOx为3.8个月),疾病进展或死亡风险降低59%,ORR提升至70.3%(R-GemOx为40.0%),完全缓解(CR)率提高至51.4%(R-GemOx为24.3%)。
安全性方面,联合治疗方案不良事件发生率与传统化疗相当,且细胞因子释放综合征(CRS)发生率低(约25%,其中≥2级事件不足5%),无免疫效应细胞相关神经毒性综合征(ICANS)报告,治疗中断率较低(2.2%)。该方案无需传统化疗,具备门诊治疗潜力,已获NCCN指南2A类推荐,为不适合移植的患者提供了新的治疗选择。
抗-CD19 ADC:Loncastuximab tesirine(Zynlonta)——与双抗联用进入“高反应率时代”
ADC Therapeutics公司于2025年12月3日公布了LOTIS-7 Ib期临床试验[3]的更新数据,评估Zynlonta与双特异性抗体格菲妥单抗联合治疗R/R 弥漫性大B细胞淋巴瘤(DLBCL)患者的疗效与安全性。
在至少随访6个月的49例可评估患者中,联合疗法展现出显著疗效:总体缓解率达89.8%,CR率达77.6%;在24例复发患者中,ORR为100%,CR率为91.7%,在25例原发难治患者中,ORR为80%,CR率为64%。
安全性方面,≥3级治疗相关不良事件主要为中性粒细胞减少、γ-谷氨酰转肽酶(GGT)升高等,CRS发生率为36.7%(其中选定剂量150 µg/kg组为25.0%),ICANS发生率仅为4.1%。
该试验预计于2026年上半年完成约100例患者入组,完整数据计划于2026年底在医学会议公布并提交发表。
抗-CD30 ADC :Brentuximab vedotin(Adcetris)
2025年1月发表的ECHELON-3 III期随机双盲临床试验[4]结果显示,Adcetris联合来那度胺及利妥昔单抗对比安慰剂联合来那度胺及利妥昔单抗,在R/R DLBCL患者中显示出显著的生存获益。
中位随访16.4个月时,联合治疗组的中位总生存期(OS)为13.8个月,显著优于对照组的8.5个月,死亡风险降低37%;中位PFS也显著延长(4.2个月vs 2.6个月,疾病进展或死亡风险降低47%)。ORR和CR率在联合治疗组分别达到64%和40%,均显著高于对照组。
两组治疗相关不良事件发生率相当,最常见不良反应均为血液学毒性。该结果表明,Adcetris联合方案为经多线治疗的R/R DLBCL患者提供了具有显著生存优势且安全性可控的治疗选择。
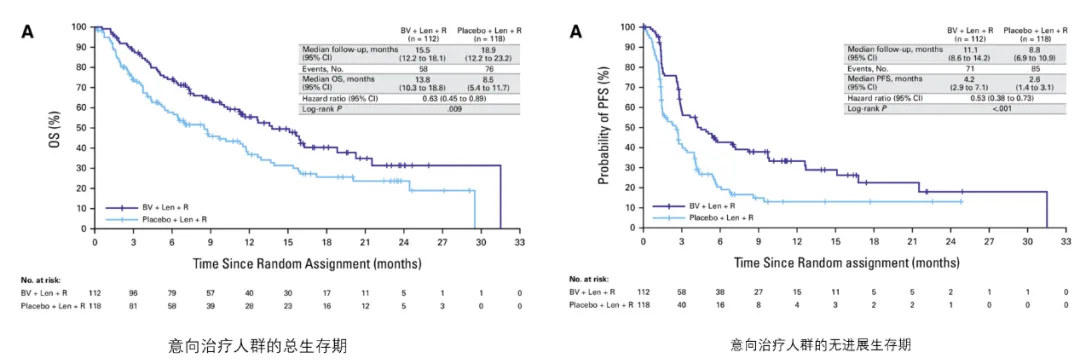
ECHELON-3 III期研究PFS与OS结果
抗-CD79b ADC :SHR-A1912——国产ADC的快速崛起
2025年ASCO会议上公布了在一项针对不适合移植的R/R DLBCL患者的研究结果,SHR-A1912联合R-GemOx方案展现出具有前景的疗效与可控的安全性[5]。
在37例接受推荐2期剂量(1.8 mg/kg,每3周静脉给药)治疗的患者中,ORR达73.0%,CR率达51.4%,中位应答时间为1.4个月。
安全性方面,56.8%的患者发生≥3级治疗相关不良事件,主要表现为血小板减少、白细胞减少和中性粒细胞减少等血液学毒性。该联合方案在难治性患者中显示出快速且持续的肿瘤缓解,为现有治疗选择有限的群体提供了新的潜在治疗策略。
如果说CAR-T是“重武器”,那么ADC则更像“轻巧但致命的精准导弹”。
2025年的ADC,正悄悄改变R/R DLBCL患者的治疗体验——更精准、更温和,更适合门诊使用。
02|双特异性抗体——
从“不够成熟”到“即将进入主流”
BsAb最大的革命性在于:
即用型
快速起效
可作为CAR-T的前后线治疗
适用于不适合移植/无法等待CAR-T制备的患者
2025年是BsAb真正“走进临床实践”的关键年份。
2025年双特异性抗体研究进展一览
艾可瑞妥单抗(Epcoritamab,Epkinly):皮下给药、反应迅速,成为可及性最强的免疫治疗之一
2025年5月发布的EPCORE NHL-1单臂研究结果[6]显示,艾可瑞妥单抗在针对接受过≥2线系统治疗的R/R DLBCL患者展现出显著疗效与可控的安全性。
在148例患者中,ORR为61%,CR率为38%,中位缓解持续时间(DOR)达15.6个月,CR者的中位DOR尚未达到,缓解可持续至治疗后10.2个月。
安全性方面,CRS发生率为51%,多为低级别且可控,≥3级发生率为2.5%;ICANS发生率为6%,以1-2级为主。该疗法已获NCCN指南2A类推荐用于≥3线治疗,其皮下给药方式便于门诊治疗启动,为高度难治性DLBCL患者提供了有效可及的新型治疗选择。
格菲妥单抗(Glofitamab, Columvi):STARGLO III 期(2025)把BsAb推上“指南优先推荐”
罗氏在2025年5月23日公布的STARGLOIII期研究[7]两年随访数据显示,格菲妥单抗联合吉西他滨与奥沙利铂方案在治疗不适合移植的R/R DLBCL患者中持续显示出显著的生存获益。
中位随访24.7个月时,联合治疗组中位OS尚未达到,而对照组为13.5个月,死亡风险降低40%;PFS显著延长,疾病进展或死亡风险降低59%。
此外,联合治疗组的CR率达58.5%,显著高于对照组的25.3%,在治疗结束时达到CR的患者中,89%在治疗后一年仍存活,82%维持缓解。
安全性方面,联合方案的不良事件发生率与各药物已知安全性特征一致。该方案已获NCCN指南1类优先推荐,并在全球超过30个国家获批,为早期复发或难治性DLBCL患者提供了有效且可及的固定疗程治疗选择。
莫妥珠单抗(Mosunetuzumab):与ADC联手,表现惊艳
2025公布的SUNMO III期试验结果显示,莫妥珠单抗联合Polivy在针对不适合自体干细胞移植的R/R LBCL患者中,相较于R-GemOx显示出显著更优的疗效(详情见前文ADC部分)。
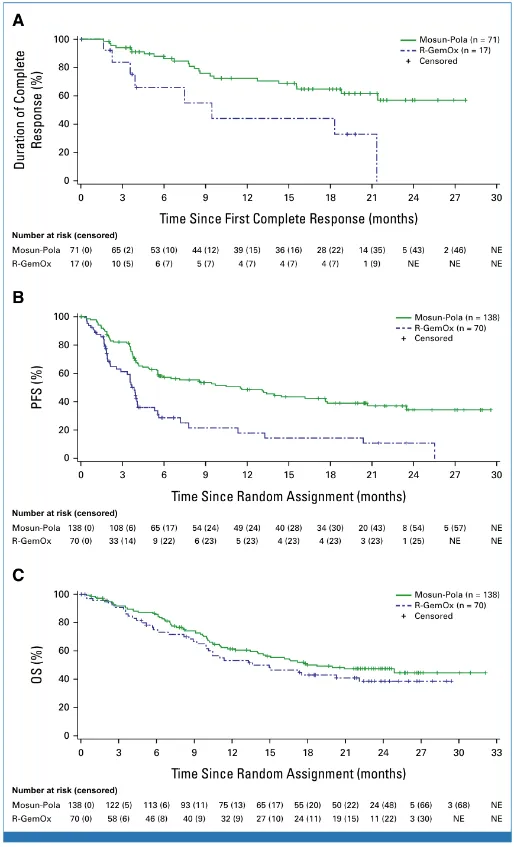
两组患者的CR持续时间,PFS,OS
Odronextamab(Ordspono):CAR-T治疗失败后的强有力选项
2025年公布的ELM-1研究扩展队列研究结果[8]显示,在针对CAR-T治疗后进展的R/R DLBCL患者中,Odronextamab单药治疗疗效良好且安全性可控:ORR为48.3%,CR率为31.7%,中位DOR为14.8个月,中位OS为10.2个月。
安全性方面,最常见的治疗相关不良事件是CRS(48.3%,均为1-2级),≥3级感染发生率为20%,未报告ICANS。
过去双抗被认为是“候补方案”,但从2025年数据来看,它们正逐渐走向前线。
更重要的是,它们为无法接受CAR-T治疗的患者提供了同样强劲的免疫武器。
03|CAR-T——更早、更快、更广
2025年,CAR-T疗法领域正从晚期挽救性治疗,逐步向更前线治疗场景拓展,这种演变的核心驱动力,来自于对多款主流CD19 CAR-T疗法‘疗效深度’与‘安全性广度’的深入比较与平衡。如下表所示,我们罗列了六款用于R/R LBCL治疗的CAR-T产品的核心数据。
2025年最大的变化在于:一方面,以瑞基奥仑赛和纳基奥仑赛为代表的中国本土创新CAR-T产品相继获批,为R/R LBCL患者提供了重要新选择;另一方面,行业整体趋势是使用时机更早、真实世界证据更成熟、生产流程更高效。
这意味着临床医生在选择时,不再仅仅依赖临床试验的理想数据,而能综合考量每款产品独特的‘疗效-安全性’图谱、患者的个体状况(如体能状态、疾病侵袭性)以及治疗的紧迫性和可及性,从而制定更个体化的治疗策略。
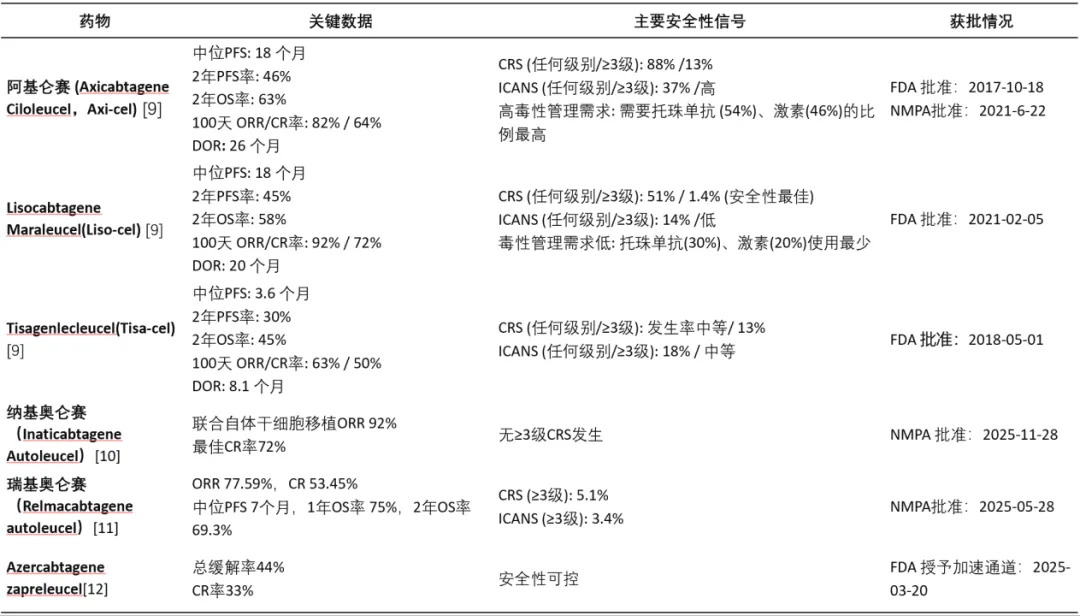
6种CAR-T对比(其中获批时间均为获批用于治疗R/R LBCL的时间)
04|小分子药物——
给无法使用大分子药物的患者更多机会
相较免疫疗法,小分子药具有口服方便、成本较低、给药灵活、适合不适合化疗/免疫疗法的特殊人群的特点。
塞利尼索(Selinexor)——老年患者的一线“无化疗”选择
2025年的一项回顾性研究[13]分析了16例接受含塞利尼索方案作为一线治疗的老年(中位年龄70.5岁)DLBCL患者,结果显示ORR为93.8%,CR率为81.3%,其中5例接受无化疗方案的患者均达CR。中位随访8.5个月,1年PFS为79.6%,81.3%的患者缓解持续≥6个月。
安全性方面,常见血液学不良事件包括白细胞减少(93.8%)、中性粒细胞减少(81.3%)等,非血液学不良事件多为1-2级且可控。该研究表明含塞利尼索方案在老年DLBCL患者中具有良好疗效与可控安全性,尤其为不适合化疗者提供了新选择。2024年7月5日中国批准口服塞利尼索片用于R/R DLBCL。
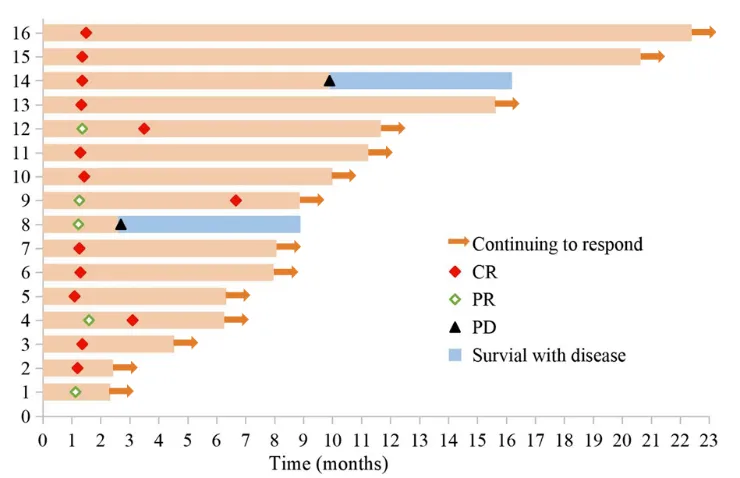
该研究中16名患者的临床结局
泽布替尼(Zanubrutinib) ——2025年II期试验证实疗效优良
2025年发布的一项单臂II期临床试验[14]评估了“无化疗”方案泽布替尼联合利妥昔单抗和来那度胺作为一线治疗,用于≥75岁初治DLBCL患者的疗效与安全性。
结果显示,在40例入组患者中,诱导治疗结束时的CR率为65%,2年无进展生存率和总生存率分别为67.1%和82.4%。
最常见的3-4级血液学不良事件为中性粒细胞减少(35%),最常见的非血液学不良事件为转氨酶升高(12.5%)和肺部感染(12.5%),未观察到心房颤动。该方案为此类不适合标准化疗的老年患者提供了有效且安全的治疗新选择。
05|不同治疗方式比较
(综合2025年证据)
综合2025年的这些研究进展,和LBCL患者的自身情况,合理选择治疗方案:

不同治疗方式风险、给药方式、成本比较
DLBCL的治疗从未像今天这样充满希望。在过去,人们往往害怕“复发”两个字;但现在,随着ADC、BsAb、CAR-T、小分子药物相继成熟,即使在多线治疗后,我们依然有越来越多的武器可用。
2025年的这些突破,不仅是数字的改善,更是“选择权”的回到患者手中——选择更轻松、更多样、更个体化的治疗方式。希望永远在更新,治疗也在不断进步。
现有多项淋巴瘤临床试验正在各大医院招募受试者,欢迎咨询!

凯石招募——临床试验招募平台
参与临床试验的患者,可以免费用试验新药,与试验相关的检查也是免费的。
目前有CAR-T、TIL等细胞疗法,PD-1/PD-L1等免疫治疗药物,小分子抑制剂、双抗、单抗、ADC等靶向药物的临床试验正在进行中。
正在招募肺癌、食管癌、肝癌、胃癌、结直肠癌、宫颈癌、卵巢癌、乳腺癌、胆管癌、子宫内膜癌、黑色素瘤、肉瘤、恶性血液疾病、淋巴瘤等各种恶性肿瘤,想要了解或者参加临床试验项目,可以咨询我们医学部的老师。

信息来源:
[1]https://www.roche.com/media/releases/med-cor-2025-06-20
[2]Budde, Lihua E et al. “Mosunetuzumab Plus Polatuzumab Vedotin in Transplant-Ineligible Refractory/Relapsed Large B-Cell Lymphoma: Primary Results of the Phase III SUNMO Trial.” Journal of clinical oncology : official journal of the American Society of Clinical Oncology, JCO2501957. 2 Oct. 2025
[3]https://ir.adctherapeutics.com/2025-12-03-ADC-Therapeutics-Announces-Updated-Data-from-LOTIS-7-Phase-1b-Clinical-Trial-of-ZYNLONTA-R-in-Combination-with-Bispecific-Antibody-Supporting-Potential-Best-in-Class-Regimen-in-Patients-with-Relapsed-Refractory-Diffuse-Large-B-cell-Lymphoma
[4]Bartlett, Nancy L et al. “Brentuximab Vedotin Combination for Relapsed Diffuse Large B-Cell Lymphoma.” Journal of clinical oncology : official journal of the American Society of Clinical Oncology vol. 43,9 (2025): 1061-1072.
[5]https://ascopubs.org/doi/10.1200/JCO.2025.43.16_suppl.7013
[6]https://www.epkinlyhcp.com/dlbcl?utm_id=CVfa8b6c5324bf4ae68d2730ce5e82c552&utm_campaign=campaign-agnostic&utm_source=google&utm_medium=paid-search&utm_content=COM-US-EPK-0001564&CID=ppc_epkinly_lbcl_textad_hcp_2024_dual&gclsrc=aw.ds&&us_privacy=${us_privacy}&gad_source=1&gad_campaignid=21366173430&gbraid=0AAAAApi4kQY8zmEHC_XG0IdwAEAs027Ke&gclid=CjwKCAiAxc_JBhA2EiwAFVs7XHkz65N373JNjB3lbX-HkUjVI6tQzeifd3zvbY5QQd4Mp-VBbudw1BoCNbUQAvD_BwE
[7]https://www.roche.com/media/releases/med-cor-2025-05-23
[8]Topp, Max S et al. “Odronextamab monotherapy in R/R DLBCL after progression with CAR T-cell therapy: primary analysis of the ELM-1 study.” Blood vol. 145,14 (2025): 1498-1509.
[9]Deschênes-Simard X, Bromberg M, Devlin SM, et al. Comparative real-world outcomes of CD19-directed CAR T-cell therapies in large B-cell lymphoma. Blood Adv. 2025;9(21):5571-5584.
[10]https://www.prnewswire.com/apac/news-releases/inaticabtagene-autoleucel-yorwidatm-new-drug-application-for-lymphoma-approved-chinas-innovative-car-t-enters-a-new-era-of-dual-indications-302628059.html
[11]Ying, Zhitao et al. “Long-term outcomes of relmacabtagene autoleucel in Chinese patients with relapsed/refractory large B-cell lymphoma: Updated results of the RELIANCE study.” Cytotherapy vol. 25,5 (2023): 521-529.
[12]https://www.cancernetwork.com/view/fda-grants-fast-track-designation-to-azer-cel-in-r-r-dlbcl
[13]Li, Jing et al. “Efficacy and safety of selinexor-based regimens as first-line treatments for elderly patients with diffuse large B-cell lymphoma: a real-world study.” BMC cancer vol. 25,1 878. 15 May. 2025
[14]Xu, Peng-Peng et al. “A phase 2 study of zanubrutinib in combination with rituximab and lenalidomide in de novo diffuse large B-cell lymphoma.” Blood vol. 146,21 (2025): 2561-2573.