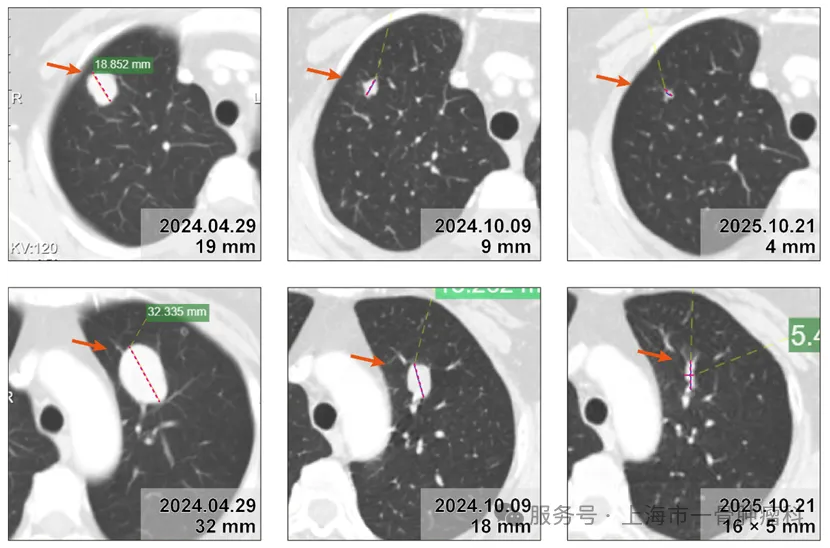
1例晚期滑膜肉瘤患者,参加TCR-T临床试验(TC-N201),18个月随访病灶持续缩小,缩小超过75%
2025-12-02
HLA-A2:A1为11∶1,NY-ESO-1阳性,符合入组标准。2024年3月28日完成单采期入组,2024年4月19日入院实施清淋预处理后,给予TC-N201注射液治疗,并联合IL-2进行免疫激活。
截至随访约18个月,肺部转移靶病灶显著缩小,肿瘤总径较基线减少>75%,达到部分缓解(PR),且随访中继续减小。

参与临床试验的患者,可以免费用试验新药,与试验相关的检查也是免费的。
目前有CAR-T、TIL等细胞疗法,PD-1/PD-L1等免疫治疗药物,小分子抑制剂、双抗、单抗、ADC等靶向药物的临床试验正在进行中。
正在招募肺癌、食管癌、肝癌、胃癌、结直肠癌、宫颈癌、卵巢癌、乳腺癌、胆管癌、子宫内膜癌、黑色素瘤、肉瘤、恶性血液疾病、淋巴瘤等各种恶性肿瘤,想要了解或者参加临床试验项目,可以咨询我们医学部的老师。

参考文献:
2.国家药品监督管理局药品审评中心(CDE)官网.
3.FDA grants accelerated approval to afamitresgene autoleucel for unresectable or metastatic synovial sarcoma.
4.FDA signs off on Adaptimmune's Tecelra as the first engineered cell therapy for a solid tumor,Fierce Pharma官网,文章发布于2024年8月2日.