CAR-T治疗晚期胃癌再添新发现:合并用药对疗效影响结果出炉,感染性抗生素让疗效“折半”?肠道菌群竟是关键调节因子
在肿瘤免疫治疗领域,CAR-T 细胞疗法无疑是颠覆传统治疗模式的 “明星技术”。尤其是针对 Claudin18.2(CLDN18.2)这一胃癌特异性靶点的 CAR-T 疗法,为晚期胃癌患者带来了新的生存希望。但临床治疗中,患者常需同时使用多种合并用药,这些药物是否会影响 CAR-T 的疗效?一直是临床医生和研究人员关注的核心问题。
近日,发表于nature子刊《British Journal of Cancer》上的一项重磅临床研究,旨在全面评估联合用药对接受CLDN18.2特异性CAR-T细胞疗法的晚期胃癌(GC)患者临床结局的影响。首次系统揭示了合并用药对 CLDN18.2 特异性 CAR-T 治疗晚期胃癌疗效的影响,更发现了肠道菌群与治疗响应的密切关联,为临床优化治疗方案提供了关键依据!
01|研究详情:
设计严谨的 I 期临床试验解析
试验设计与入组人群
该研究为回顾性临床分析,纳入了 2019 年 3 月至 2022 年 1 月期间,参与 CLDN18.2 特异性 CAR-T 疗法(CT041)I 期临床试验(NCT03874897)的 72 例晚期胃癌患者。
入组标准:
·年龄 18-75 岁;
·经组织学证实为 CLDN18.2 阳性晚期胃癌;
·至少接受过一线治疗失败;
·ECOG 评分 0-1 分(93.1% 患者为 1 分)。
治疗方案:
患者先接受白细胞分离术,随后进行清淋化疗,最后输注自体 CLDN18.2 特异性 CAR-T 细胞。CAR-T 细胞剂量采用改良 “3+3” 设计的剂量递增 / 递减方案,主要剂量为 2.5×10⁸ cells(90.3% 患者),部分患者接受 3.75×10⁸ cells(6.9%)或 5×10⁸ cells(2.8%)。
合并用药定义与分类
合并用药指 CAR-T 细胞输注前后 30 天内使用的任何药物,具体包括:
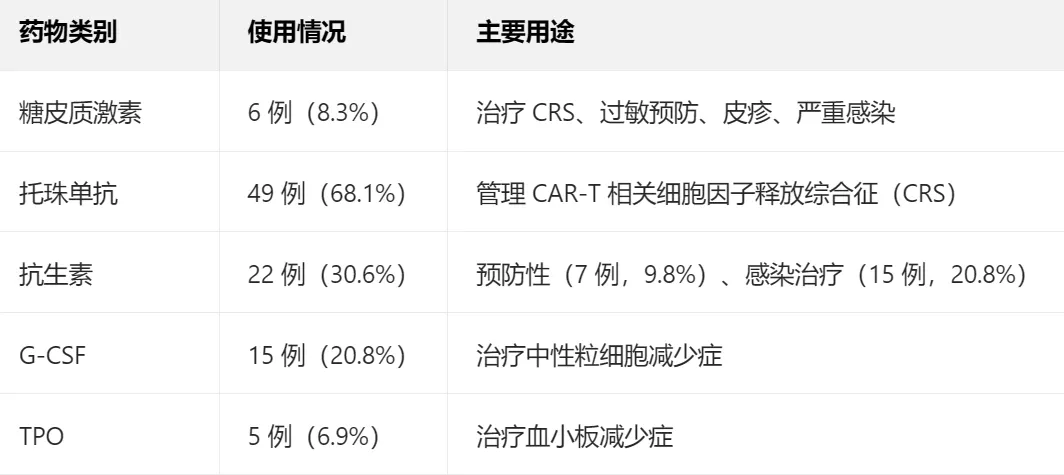
疗效评估指标
·主要终点:客观缓解率(ORR)、无进展生存期(PFS)、总生存期(OS);
·评估标准:按照实体瘤疗效评价标准(RECIST)1.1 版;
·随访时间:中位随访 29.9 个月(95% CI 28.3-32.0 个月)。
02|关键结果:
这些数据改写临床实践
1. 感染性抗生素显著削弱 CAR-T 疗效
这是本研究最核心的发现!与未使用感染性抗生素的患者相比,使用该类药物的患者:
·中位 PFS:2.6 个月 vs 5.8 个月(P<0.001);
·中位 OS:3.9 个月 vs 9.5 个月(P<0.001);
·多因素分析显示:感染性抗生素使用是 PFS(HR=4.66,95% CI 1.79-12.1,P=0.002)和 OS(HR=6.93,95% CI 2.56-18.8,P<0.001)的独立不良预后因素。

图 1 不同合并用药对患者 PFS 的影响e 图 “感染性抗生素组 PFS 曲线”
从生存曲线可见,感染性抗生素组的 PFS 和 OS 曲线均显著低于无感染性抗生素组,差距极具统计学意义。而用于预防目的的抗生素(如治疗发热性中性粒细胞减少、CRS 与感染难以区分的发热),对 PFS 和 OS 无显著影响(P=0.618、P=0.030)。
2. 其他合并用药对疗效无负面影响
·糖皮质激素:使用与未使用患者的 ORR、PFS、OS 均无显著差异(P 值分别为 0.991、0.873、0.991),即使用于 CRS 管理也未削弱 CAR-T 疗效;
·托珠单抗:68.1% 的患者因 CRS 使用托珠单抗,其 PFS(4.2 vs 5.5 个月,P=0.213)和 OS(11.5 vs 8.0 个月,P=0.086)与未使用组无统计学差异;
·G-CSF:使用组 ORR 显著更高(73.3% vs 36.8%,P=0.011),且 PFS、OS 无负面影响,提示其可能通过改善中性粒细胞减少、减少感染风险间接获益;
·TPO:使用与未使用组的生存数据无显著差异(P=0.871、P=0.410)。

图 2 不同合并用药对患者 OS 的影响(e 图 “感染性抗生素组 OS 曲线”)
3. 肠道菌群:CAR-T 疗效的 “隐形调节器”
研究对 35 例患者治疗前的粪便样本进行宏基因组测序,发现:
·应答者(R)肠道中,核梭杆菌(Fusobacterium nucleatum)、粘液乳杆菌(Lactobacillus mucosae)、苍白普雷沃菌(Prevotella pallens)、假肺炎链球菌(Streptococcus pseudopneumoniae)丰度显著更高;
·无应答者(NR)肠道中,艰难梭菌(Clostridioides difficile)丰度更高;
·功能通路分析:应答者甲烷代谢通路富集,无应答者氨基酰 - tRNA 生物合成、群体感应等通路富集。
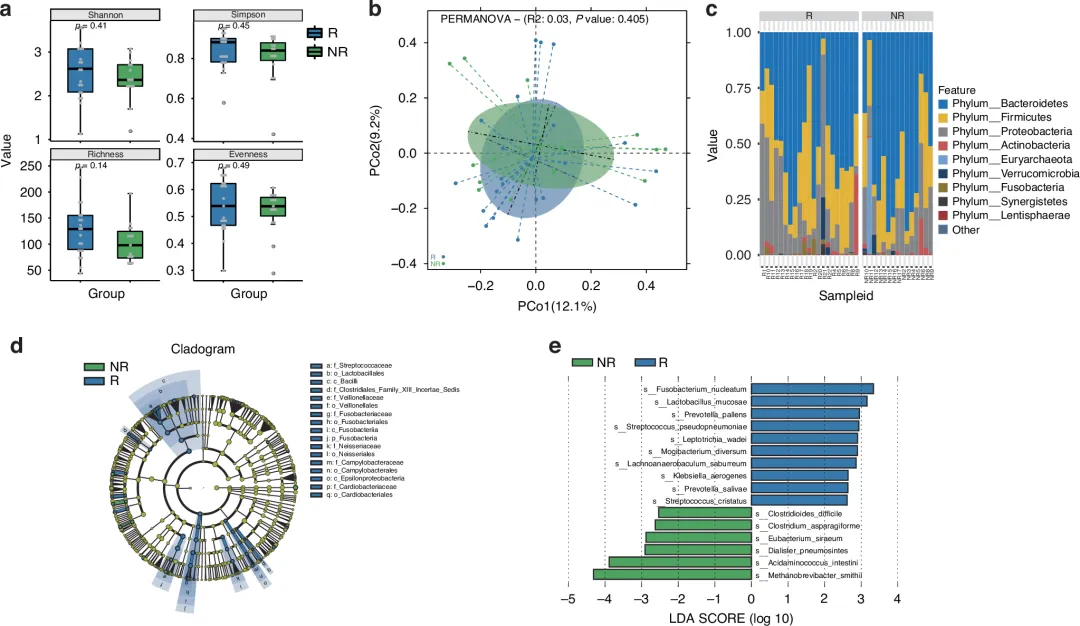
图 3 肠道菌群与 CAR-T 疗效的关联(e 图 “差异物种 LDA 评分”,蓝色标注应答者富集的 4 种菌群)
这些菌群此前已被证实与肿瘤免疫治疗疗效相关,例如核梭杆菌可下调 CD8+T 细胞的 PD-1 表达,重新激活其抗肿瘤功能,为后续通过调节肠道菌群优化 CAR-T 疗效提供了靶点。
03|临床意义:
为CAR-T 治疗提供实操性指导
1.抗生素使用需“精准把控”:避免在 CAR-T 治疗前后 30 天内不必要地使用广谱抗生素,对于确需治疗感染的患者,应优先选择窄谱抗生素,并缩短疗程;
2.合并用药“无需过度顾虑”:CRS 管理中,托珠单抗和糖皮质激素可安全使用,无需担心削弱疗效;中性粒细胞减少患者可积极使用 G-CSF,既改善毒性又不影响疗效;
3.肠道菌群可作为“疗效预测标志物”:未来可通过检测粪便中核梭杆菌等菌群丰度,筛选 CAR-T 潜在获益人群,或通过益生菌补充、粪菌移植等方式优化肠道菌群,提升治疗响应。
04|结语
这项来自北京大学肿瘤医院的I 期临床试验,首次明确了合并用药对CLDN18.2 特异性 CAR-T 治疗晚期胃癌的影响,尤其揭示了感染性抗生素的“疗效削弱效应” 和肠道菌群的关键作用。这一发现为临床制定更精准的 CAR-T 治疗方案提供了高级别证据,有望进一步提升晚期胃癌患者的治疗获益!
随着CAR-T 疗法在实体瘤领域的不断突破,CLDN18.2 靶点的相关研究持续升温。期待未来更多临床数据出炉,为肿瘤患者带来更安全、更有效的治疗选择!
现有多项胃癌临床试验正在各大医院招募受试者,欢迎咨询!

项目 | 靶点 | 适应症 | 要求 |
BC007 | CLDN18.2 | 胃癌 | ≥18 |
XNW27011 | CLDN18.2 | 胃癌 | ≥18岁,既往至少2种系统性治疗并发生疾病进展 |
纳米炭铁混悬注射液 | 瘤内给药 | 胃癌,胰腺癌、乳腺癌、肺癌、等实体瘤 | 18~80,标准治疗失败 |
GenSci128 片 | TP53 Y220C | 实体瘤 | ≥18 岁,标准治疗失败 |
HJ891 | KRAS G12C | 实体瘤(除肺癌) | ≥18 岁,标准治疗失败,未用过KRAS |
KY-0301 | ADC药物 | 实体瘤 | 18~75 |
凯石招募——临床试验招募平台
参与临床试验的患者,可以免费用试验新药,与试验相关的检查也是免费的。
目前有CAR-T、TIL等细胞疗法,PD-1/PD-L1等免疫治疗药物,小分子抑制剂、双抗、单抗、ADC等靶向药物的临床试验正在进行中。
正在招募肺癌、食管癌、肝癌、胃癌、结直肠癌、宫颈癌、卵巢癌、乳腺癌、胆管癌、子宫内膜癌、黑色素瘤、肉瘤、恶性血液疾病、淋巴瘤等各种恶性肿瘤,想要了解或者参加临床试验项目,可以咨询我们医学部的老师。

参考文献:
Li J, Liu L, Tao M, et al. Impact of concomitant medications on efficacy of CLDN18.2-specific CAR-T cell therapy in advanced gastric cancer [J]. British Journal of Cancer, 2025.
https://doi.org/10.1038/s41416-025-03289-7.