套细胞淋巴瘤进入“无化疗时代”?ALR/ALO一线深度缓解、可停药研究重塑治疗格局
一项针对初治套细胞淋巴瘤(MCL)的II期研究显示,阿卡替尼(Acalabrutinib, A)+ 来那度胺(Lenalidomide, L)联合利妥昔单抗(Rituximab,R)或奥妥珠单抗(Obinutuzumab, O) 的一线治疗方案(ALR / ALO),实现了极高的分子学缓解率。
研究采用最小残留病灶(MRD)动态监测的“限时治疗”策略,让部分患者得以安全停药。ALR组4年总生存期(OS)达91%,ALO组则展现出更快的MRD清除能力。本文将为您解读这项研究的核心发现。
01|为什么越来越多专家认为
“MCL未来可能不再依赖化疗”?
传统化疗方案虽可改善MCL的短期缓解,但长期生存仍有限,且毒副反应较大。随着BTK抑制剂(如阿卡替尼)、免疫调节剂(如来那度胺)和强化型抗CD20抗体(如奥妥珠单抗)的应用日益增多,多种免化疗组合在复发/难治MCL中已显示可观疗效。
因此,能否通过三联免化疗方案获得足够深度的缓解,从而达到“限时用药、早期停药”的目标?为了解决这一问题,康奈尔大学威尔康奈尔医学院阮嘉教授团队牵头了一项II期临床研究[1],评估了阿卡替尼联合来那度胺及利妥昔单抗(ALR)或奥妥珠单抗(ALO)作为一线治疗MCL的疗效与安全性,并重点探索了基于MRD监测的停药策略。
02|一项真正做到“能停则停”的研究:
MRD 引导下的个体化限时治疗设计
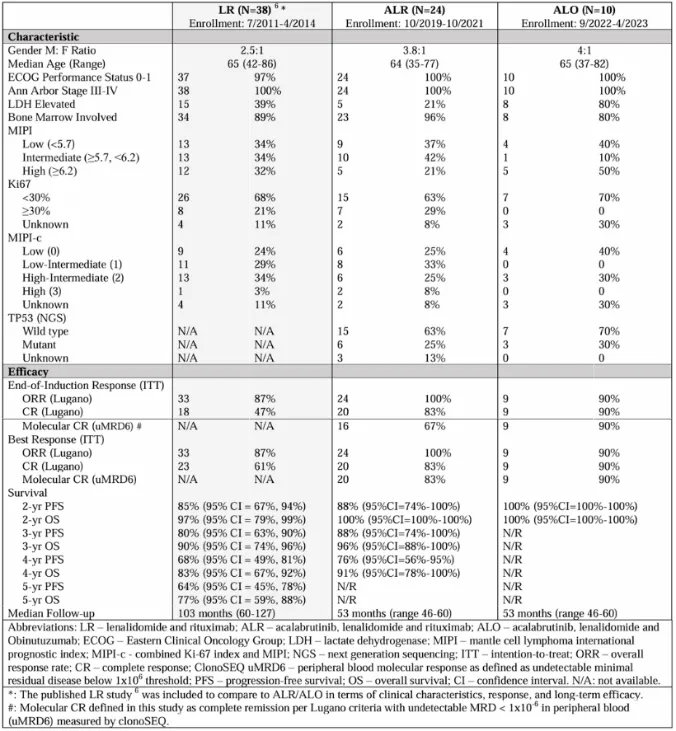
表1 患者基线特征与治疗效果
该研究纳入了需系统治疗的初治MCL患者,分为两个队列:
·ALR队列 (n=24):阿卡替尼+来那度胺+利妥昔单抗
·ALO队列 (n=10):阿卡替尼+来那度胺+奥妥珠单抗
主要终点为12个周期诱导治疗后的分子学完全缓解率(molecular CR),定义为Lugano标准下的CR且外周血中通过clonoSEQ检测MRD <10⁻⁶ (uMRD6)。
独特的停药规则:如果患者达到uMRD阴性的分子学CR,可在24个周期后停止口服药物(阿卡替尼+来那度胺),仅保留抗CD20抗体治疗至36个周期。
ALR组还额外进行了肿瘤循环游离DNA(cfDNA)的CAPP-Seq分析,以探索克隆演化的动态过程。
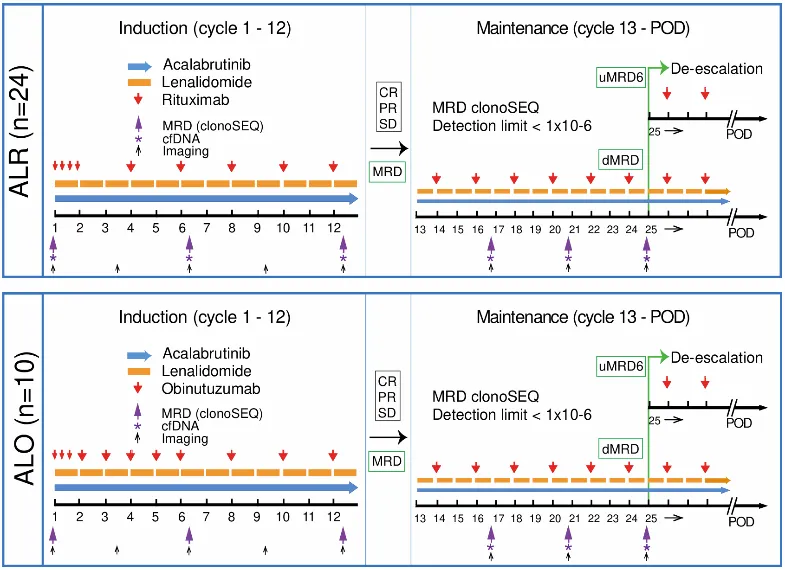
图1 本研究中ALR和ALO方案示意图
03|疗效数据:
深度分子缓解与长期生存
ALR队列(中位随访53个月):
·客观缓解率 (ORR):100%。
·完全缓解率 (CR):12个周期诱导后为83%。
·分子学缓解 (uMRD6):诱导结束时67%的患者达到uMRD,最佳uMRD率达83%。
·生存数据:3年无进展生存期(PFS)为88%,OS为96%;4年PFS为76%,OS为91%。
·风险因素:TP53突变与较差的PFS相关 (p=0.026)。
ALO队列(中位随访25个月):
·缓解率:诱导治疗后ORR、CR及分子学CR (uMRD6) 均为90%。
·MRD清除速度:诱导结束时90%患者达到uMRD率,提示奥妥珠单抗可能具备更强的深度清除能力,但样本量尚小,需要进一步验证。
·生存数据:2年OS和PFS均为100%。
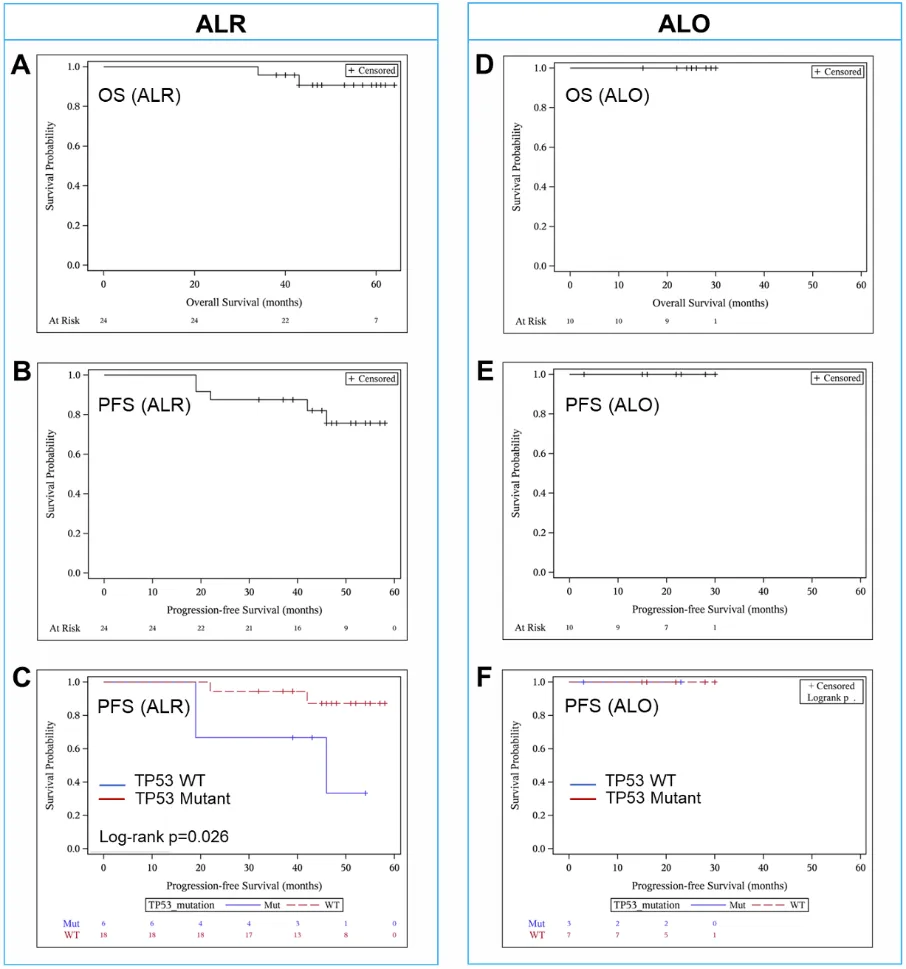
图2 患者生存曲线
04|安全性:
总体可控,无新安全信号
整体方案耐受性良好,未出现非预期的毒性信号。常见不良事件包括:
·血液学毒性:3-4级中性粒细胞减少症在ALR组为33%,ALO组为40%;血小板减少症在ALR组仅4%,ALO组为30%。
·非血液学毒性:主要是皮疹(ALR组为42%)、肝酶升高(ALO组20–30%)、疲劳(4%)和消化道症状(多为1–2级)。新冠疫情期间出现少量3级感染,但均康复。
·其他:ALR组有7例症状性低丙种球蛋白血症需静脉注射免疫球蛋白(IVIG) 补充,皮肤肿瘤(其中多数为低级别、可处理的皮肤肿瘤),与来那度胺的已知风险相符,未见心房颤动(常见于其他BTK抑制剂)。
05|MRD监测与cfDNA分析:
实现真正的“动态个体化治疗”
该研究利用clonoSEQ技术对患者进行了纵向MRD监测。
·在ALR队列中,24个周期后处于uMRD状态的17名患者中,有13名选择了药物“降级”治疗(停止口服药)。其中2名患者在停药期间复发(PFS分别为42和46个月),这提示了部分高危患者可能仍需维持治疗。
·在ALO队列中,9名可评估患者全部在12个周期内达到uMRD,其中6名患者在24个周期后成功执行了停药策略。
·部分TP53突变患者虽能达到MRD阴性,但复发风险更高。
研究团队还利用CAPP-Seq技术分析了cfDNA。结果表明,基线cfDNA突变谱与肿瘤组织高度一致(重合率约98%)。
·诱导治疗12周期后,患者的平均ctDNA突变丰度从基线的8.5%显著降至0.2%。
·cfDNA的动态变化能够反映疾病的克隆演变,在复发患者中可观察到克隆再扩增或新突变出现,为非侵入性监测提供了有力证据。
06|关键科学意义
这项研究证实,对于初治MCL患者,ALR和ALO这两种“去化疗”方案不仅安全,而且能带来极高的缓解率和持久的生存获益。
·限时治疗是可行的:多数达到深度分子学缓解的患者可以安全地减少药物暴露,这对于改善患者生活质量、降低经济负担具有重要意义。
·奥妥珠单抗的潜力:虽然ALO队列样本量较小,但其展现出的快速MRD清除能力值得在更大规模的随机对照试验中进一步验证。
·挑战仍在:尽管疗效显著,但TP53突变患者的预后仍劣于野生型患者,未来可能需要结合双特异性抗体或CAR-T等新疗法来攻克这一难关。
07|限时治疗vs长期维持:
临床界争论的关键问题,
被这项研究再次推到台前
随着本研究展示出在不依赖化疗的前提下依然能够实现高比例的深度uMRD6,尤其是部分患者在达到uMRD6后能够安全停用口服药物,一个长期以来在淋巴瘤治疗中备受讨论的问题再次被推到台前:
我们是否必须维持长期治疗?还是可以通过MRD等分子学指标,精准识别可停药的人群,实现真正的“限时治疗”?
在过去的淋巴瘤研究中,“长期维持治疗”与“限时治疗策略”始终存在争议,这项MCL的治疗进展又让这场争论愈发具有现实意义。
ALR/ALO研究的启示不仅在于其突出的疗效,更在于它给临床医生提出了一个更关键的问题:在深度缓解越来越可及的今天,我们是否有机会为部分患者减少治疗负担,而不牺牲长期生存?带着这个问题,我们一起看看当下淋巴瘤治疗中的两大策略:长期维持治疗和MRD驱动的限时治疗。
下文将结合既往证据、多个关键临床研究以及真实世界数据,对这两种策略的优势、风险与适用人群进行系统梳理与分析。
08|限时治疗vs长期维持
——淋巴瘤治疗的争议
长期维持(例如长期抗CD20或持续BTK抑制)与限时/停药策略(MRD驱动)各有优劣:一项对惰性非霍奇金淋巴瘤的研究表明,长期维持治疗(如每2个月或更长间隔使用利妥昔单抗)可延长无进展期(图3)[2]。
但部分试验结果(如在低肿瘤负荷滤泡性淋巴瘤初治患者中进行的RESORT试验)显示虽然维持治疗可延长PFS,但并不会改善患者OS,还会增加长期毒性与成本(表2)[3]。
限时策略可以减少过度治疗,但对复发早期预警与再治疗策略依赖于高频分子学监测[1](如前文所述研究),因而决策需个体化。
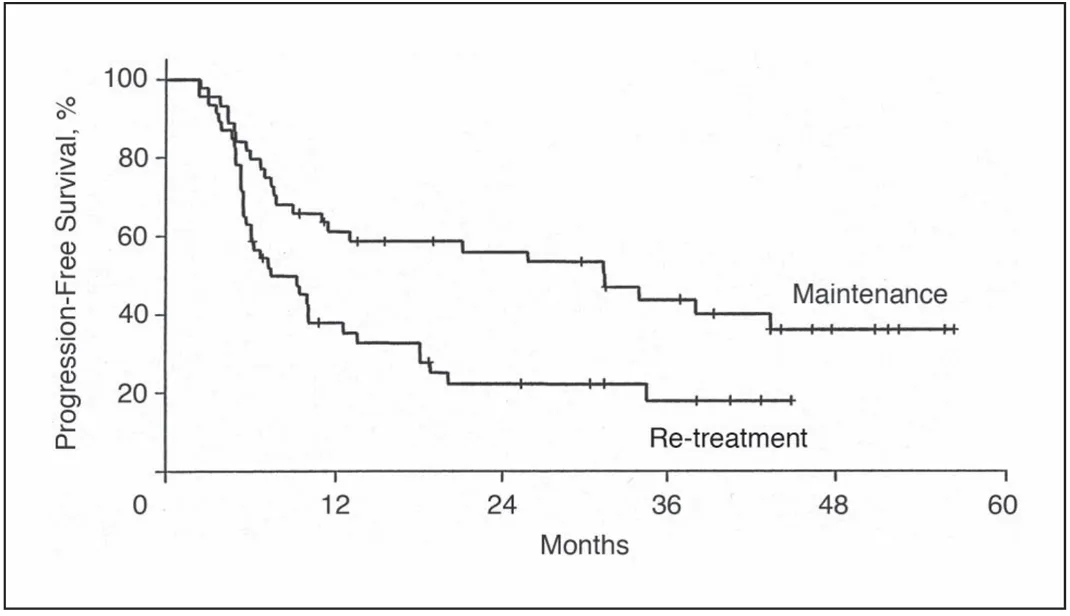
图3 使用或不使用利妥昔单抗维持治疗的惰性非霍奇金淋巴瘤患者PFS
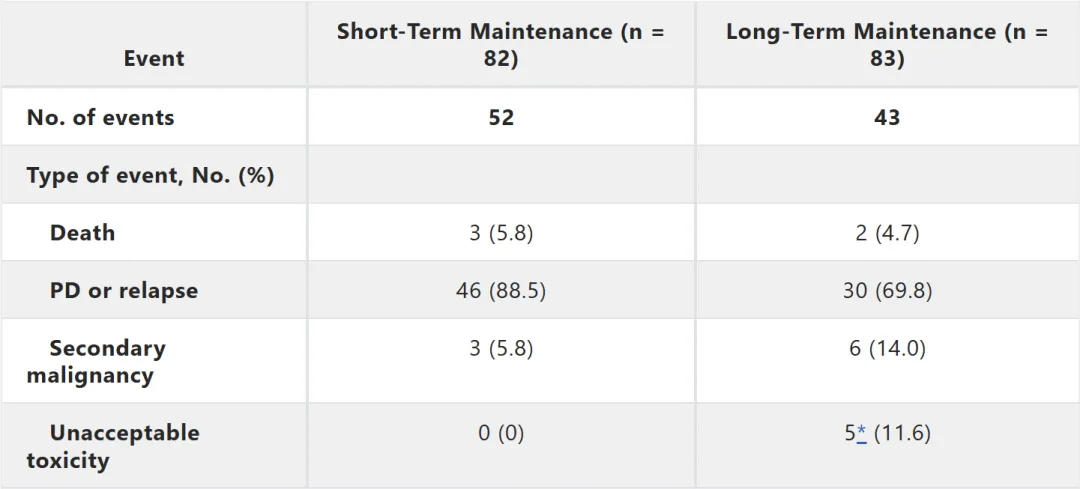
表2 使用利妥昔单抗维持治疗组和非维持治疗组事件发生率
09|停药并不简单:
MRD限时治疗模式
为什么既令人期待又充满挑战?
限时治疗的目标是识别真正达到深度分子缓解(uMRD)的患者,让他们在安全前提下减少或停止药物暴露,从而降低毒性与成本,同时保留再次治疗的策略用于复发。
上文的MCL的ALR/ALO研究,以及其他淋巴瘤MRD驱动限时治疗的试验,如在复发/难治性慢性淋巴细胞白血病患者中进行的VISION/HO141试验[4]也在尝试建立这一范式。但仍然存在一些现实挑战:
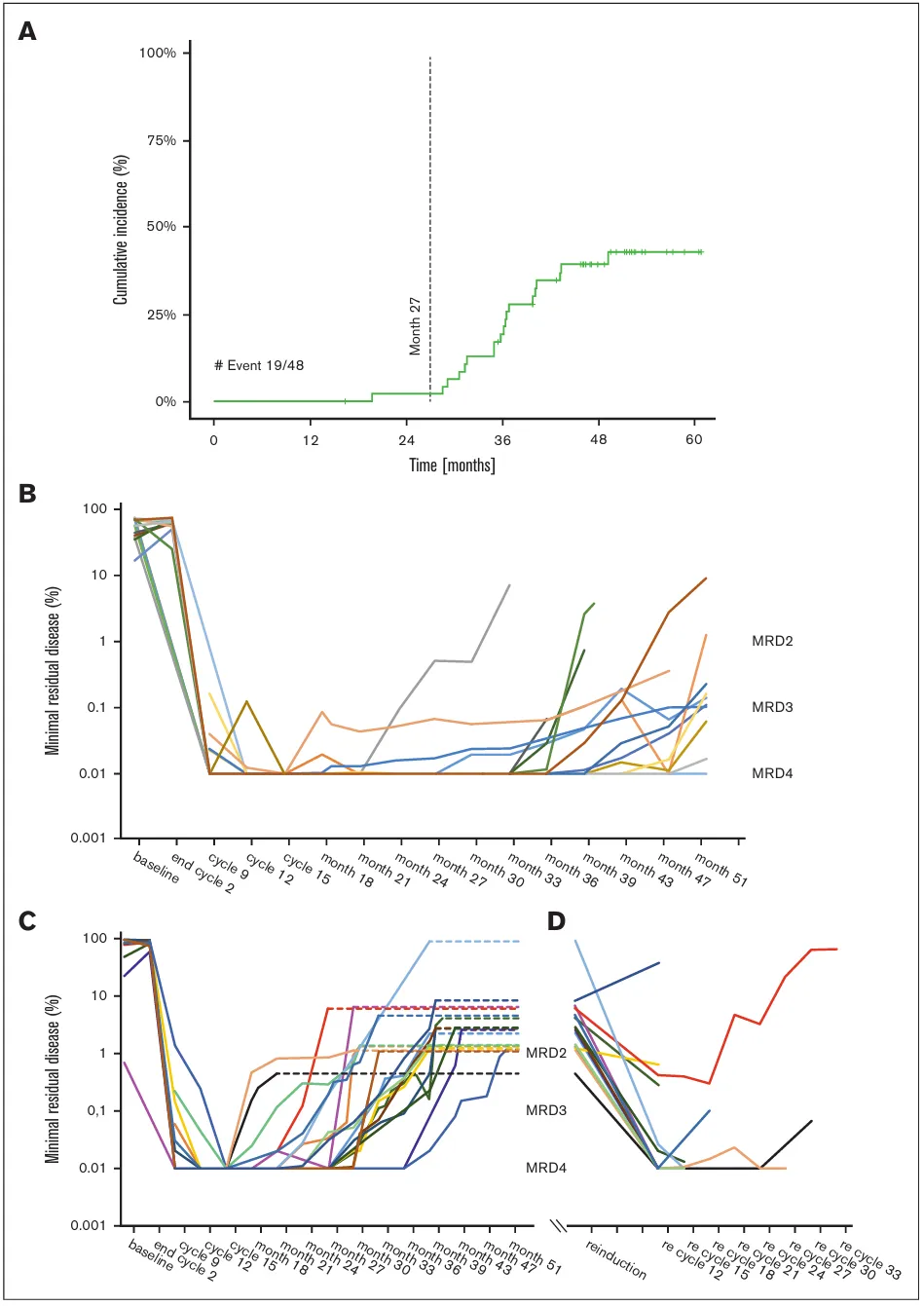
图4 MRD引导下治疗重启后的疗效与MRD动态变化
·监测频率与资源:限时策略依赖高灵敏度的MRD/NGS与cfDNA检测[1],要实现临床可行性需保证检测可及性、标准化与及时报告。
·高危亚型管理:像TP53突变这样的高风险群体即便达到MRD阴性,仍有更高复发率,可能不适合停药[1],需建立亚组判别标准。
·再治疗可行性与效果:当患者停药后复发,重新启动相同方案或改线治疗能否取得同样的缓解深度还需要进一步的研究。
·监测频率与资源:限时策略依赖高灵敏度的MRD/NGS与cfDNA检测[1,4],要实现临床可行性需保证检测可及性、标准化与及时报告。
10|未来方向:
从诱导到停药再到复发监测的
完整MRD管理路径
❶诱导期以目标为uMRD6导向(使用高效免化疗组合)。
❷对达到uMRD的患者进行风险分层(基因学如TP53等)。高危者优先继续维持或转入更强疗法,低危者可能纳入限时停药方案。
❸停药后严格分子学随访(MRD + cfDNA),一旦检测到分子学回升或临床/影像学异常,尽早干预。近年来的MRD驱动试验已显示这一方法在慢性淋巴细胞白血病中具有可行性[5]。
限时治疗与长期维持并非简单的二选一,而应基于患者的分子/临床风险、监测资源、既往/潜在毒性耐受性进行个体化选择。
随着MRD与cfDNA检测技术的成熟,基于分子分层的“限时治疗”将在更多亚组中成为现实,但对高危患者仍需维持或采用创新治疗策略。
现有多项淋巴瘤临床试验正在各大医院招募肿瘤患者,欢迎咨询!

凯石招募——临床试验招募平台
参与临床试验的患者,可以免费用试验新药,与试验相关的检查也是免费的。
目前有CAR-T、TIL等细胞疗法,PD-1/PD-L1等免疫治疗药物,小分子抑制剂、双抗、单抗、ADC等靶向药物的临床试验正在进行中。
正在招募肺癌、食管癌、肝癌、胃癌、结直肠癌、宫颈癌、卵巢癌、乳腺癌、胆管癌、子宫内膜癌、黑色素瘤、肉瘤、恶性血液疾病、淋巴瘤等各种恶性肿瘤,想要了解或者参加临床试验项目,可以咨询我们医学部的老师。

参考文献:
[1]Ruan J, Bond DA, Shah BD, et al. MRD-driven Initial Therapy of Acalabrutinib and Lenalidomide plus Rituximab (ALR) or Obinutuzumab (ALO) for Mantle Cell Lymphoma. Blood Adv. Published online November 25, 2025.
[2] Hainsworth, John D et al. “Maximizing therapeutic benefit of rituximab: maintenance therapy versus re-treatment at progression in patients with indolent non-Hodgkin's lymphoma--a randomized phase II trial of the Minnie Pearl Cancer Research Network.” Journal of clinical oncology : official journal of the American Society of Clinical Oncology vol. 23,6 (2005): 1088-95.
[3] Kahl, Brad S et al. “Rituximab extended schedule or re-treatment trial for low-tumor burden follicular lymphoma: eastern cooperative oncology group protocol e4402.” Journal of clinical oncology : official journal of the American Society of Clinical Oncology vol. 32,28 (2014): 3096-102.
[4] Niemann, Carsten U et al. “Long-term follow-up of MRD-guided ibrutinib plus venetoclax in relapsed CLL: phase 2 VISION/HO141 trial.” Blood advances vol. 9,15 (2025): 3665-3675.
[5] Munir, Talha et al. “Measurable Residual Disease-Guided Therapy for Chronic Lymphocytic Leukemia.” The New England journal of medicine vol. 393,12 (2025): 1177-1190.