化疗豁免时代加速,双药组合在R/R B-NHL淋巴瘤中实现80%高缓解率,超两成患者获两年以上持久缓解(附淋巴瘤免疫治疗总结)
对于许多B细胞淋巴瘤患者和家属来说,最担心的词莫过于——“复发”或“难治”。尽管近年来治疗手段不断增加,但一旦对现有疗法耐药,很多患者依然面临“无药可用”的艰难处境。
几天前,《Blood Advances》发表的一项I期临床研究[1]为对多种疗法无效的晚期患者带来了令人振奋的消息:双特异性抗体 Blinatumomab(贝林妥欧单抗)联合免疫调节剂 Lenalidomide(来那度胺)显示出可观疗效,并找到了多个预测疗效的“免疫标志物”。
这项研究不仅拓宽了复发难治患者的治疗选项,更“揭开”了免疫治疗组合该如何协同发挥作用的一部分机制。而这项成果,也为我们重新认识复发/难治性B细胞淋巴瘤(R/R B-NHL)的治疗格局提供了一个极好的切入点。
一个有启发意义的新进展:Blinatumomab + Lenalidomide 的“组合拳”潜力初现。
一、组合拳出击,双抗+免疫调节剂的“协同增效”机制
该研究的核心在于创新性地结合了两种强大的免疫治疗药物:贝林妥欧单抗和来那度胺,这个设计基于一个巧妙的科学假设:
● 贝林妥欧单抗像一个“智能桥梁”,一端结合淋巴瘤细胞表面的CD19抗原,另一端结合T细胞表面的CD3。它能将患者自身的T细胞“招募”到表达CD19的B-NHL肿瘤细胞身边,并激活其杀伤能力。但使用贝林妥欧单抗单药治疗的临床益处常受限于T细胞募集能力不足或不可避免的T细胞耗竭 。
● 来那度胺 则是一个多面手,不仅对淋巴瘤有直接抑制作用,更能调节肿瘤微环境,增强T细胞和自然杀伤(NK)细胞的活性和功能。
研究人员推测,来那度胺可以增强贝林妥欧单抗所招募的T细胞的“战斗力”,同时减轻T细胞在持续战斗后产生的“耗竭”状态,从而让这对组合拳发挥“1+1>2”的抗肿瘤效果。
二、突破性数据,高缓解率与两年“持久缓解”
这项I期研究共纳入34名既往中位接受过3线治疗的R/R B-NHL患者,研究主要目标是评估联合方案的安全性和确定最大耐受剂量(II期试验推荐剂量)。
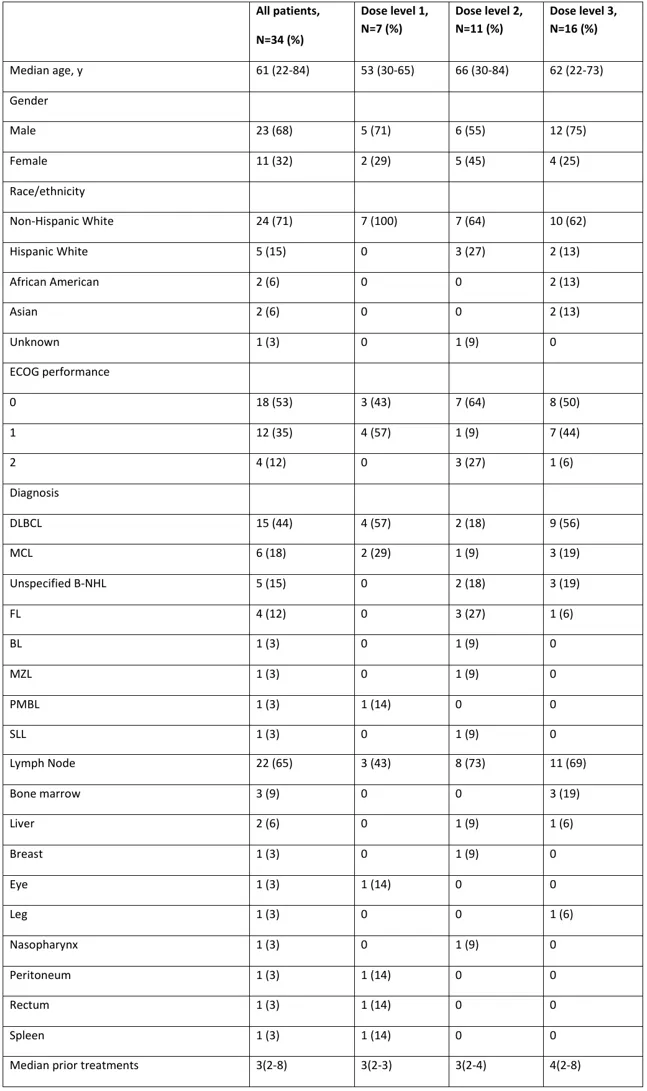
入组患者基线特征
结果非常亮眼:
● 安全性和推荐剂量:
研究探索了三种给药方案。最终确定,在56天的诱导治疗周期中,来那度胺(20mg/天,第1-21天和第29-49天)与贝林妥欧单抗(剂量递增输注,第1-7天9µg/天,第8-14天28µg /天,第15-56天112µg /天)联合使用作为II期试验剂量(RP2D)。最常见的≥2级不良反应是神经毒性(34%患者发生),但在RP2D剂量下,神经毒性发生率降至25%,且大多数可通过激素管理等手段得到控制和逆转。
● 疗效可观 & 持久缓解:
所有患者的完全缓解率(CRR)为41%,在所有完成诱导治疗的患者中,客观缓解率(ORR)高达80%,CRR达到70%。
更令人惊喜的是,有8名患者(占全部患者的24%)获得了超过2年的持久缓解,这对于重度经治的患者而言意义重大。
即使在之前CAR-T治疗失败的患者中,也有2名(29%)达到了完全缓解。
在RP2D剂量下, ORR和CRR均为44%,中位总生存期(OS)和无进展生存期(PFS)分别为未达到和5.6个月。
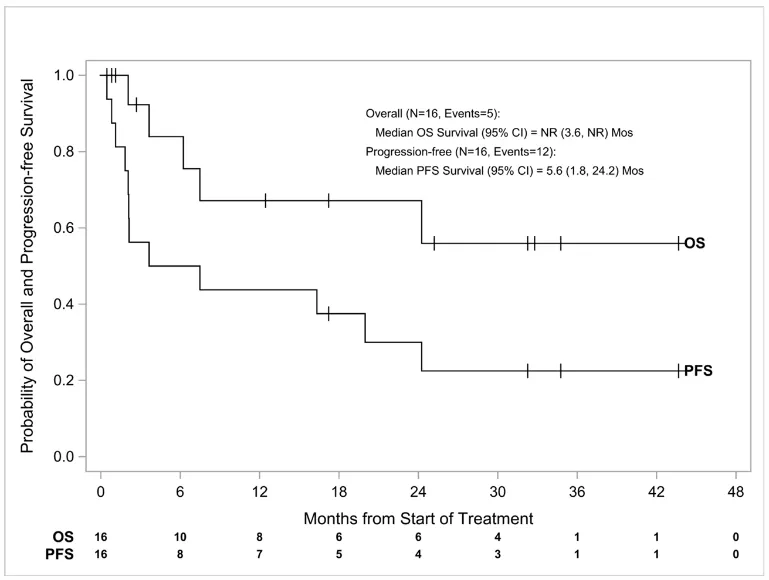
RP2D剂量组患者的生存曲线
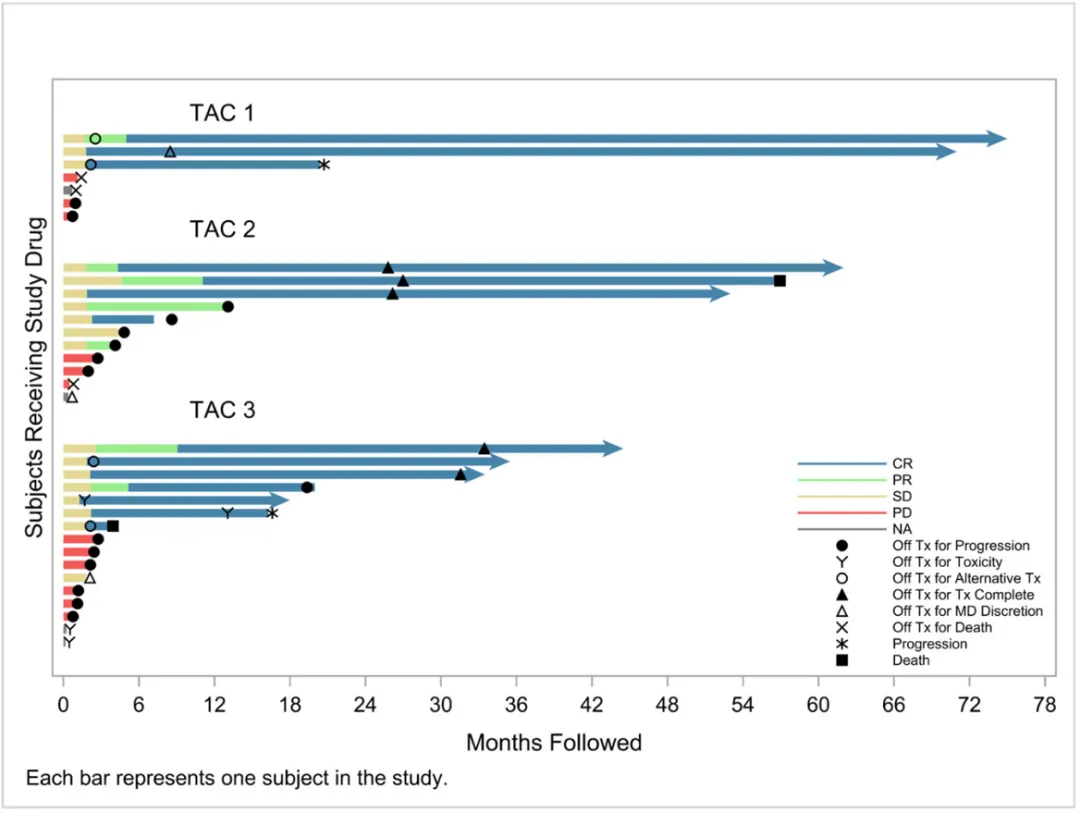
所有患者的“游泳者”图(代表每个患者的治疗和响应持续时间)
三、机制揭秘,两大“黄金”生物标志物浮出水面
除了发现联合治疗方案疗效显著,本研究的一大亮点是进行了免疫相关性分析,它不仅为联合疗法的机制提供了更深入的理解,更首次确定了潜在的疗效预测生物标志物。
1. NK细胞亚群——疗效的“先锋预报员”:
研究发现,治疗前外周血中GranB+CD56brightCD16dimCD11b+NK细胞比例较高的患者,更有可能获得完全缓解。这一指标在预测疗效上表现出极高的准确性(AUC = 0.90)。
2. 记忆性Treg细胞——意想不到的“好信号”:
本研究发现,在Treg细胞中,记忆性Treg亚型占比较高的患者,疗效更好。这与团队之前其他免疫疗法的研究结果一致,提示记忆性Treg可能是一个跨疗法的、通用的疗效预测标志。
3. 免疫因子平衡——微环境的“晴雨表”:
分析显示,治疗前IFN-γ/IL-10分泌性T细胞的比值较高的患者,更容易获得完全缓解。
4. 减轻T细胞耗竭——联合疗法的“附加价值”:
对比不同给药方案发现,与贝林妥欧单抗同步使用来那度胺,能够显著降低T细胞上耗竭标志物LAG-3的表达。
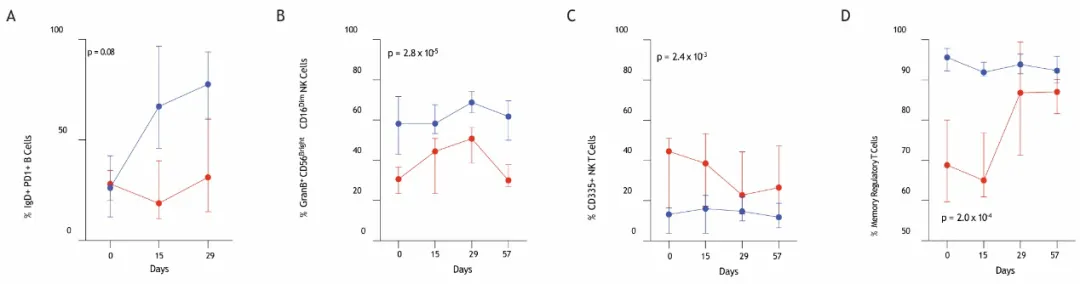
预测疗效的免疫指标(蓝色为完全缓解的患者,红色为疾病稳定或进展的患者)
这些发现不仅有助于未来精准选择患者,也为“免疫联合免疫”这种策略提供了坚实的机制依据。
这个研究告诉我们:复发难治并不意味着无路可走,免疫治疗组合正在不断带来突破。
接下来,让我们从更宏观的角度,盘点目前国际上可用于复发/难治性B细胞淋巴瘤的主流免疫治疗手段——它们共同构成了新的治疗格局,让越来越多患者有机会再次看到希望。
四、双特异性抗体,像“精准导弹”一样的免疫治疗
双特异性抗体(简称“双抗”)是一类非常新颖的药物,它能同时抓住肿瘤细胞和T细胞(免疫细胞),把两者“拉”到一起,让免疫系统更精准地攻击肿瘤。可以简单理解为:把免疫细胞“牵引”到癌细胞面前,帮助身体自己杀死肿瘤。一起看看目前国际上最重要的几款双抗:
❶Epcoritamab(艾可瑞妥单抗)
2024年,权威期刊《Leukemia》公布了CD3xCD20双特异性抗体Epcoritamab关键性EPCORE NHL-1试验的2年长期随访数据[2]。该研究报道了157名接受Epcoritamab治疗的R/R LBCL患者,经过中位25.1个月(超过2年)的长期随访后的数据。这是一群非常难治的患者:中位接受过3线治疗,60.5%为原发难治,75.2%对至少2线治疗耐药,更有38.9%的患者此前接受过CAR-T治疗。
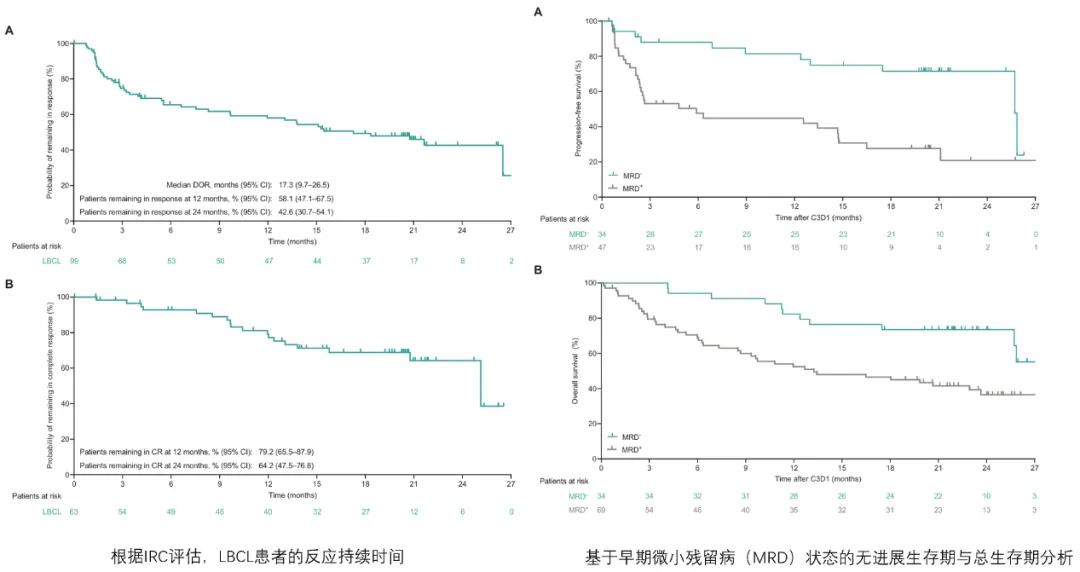
弥漫性大B细胞淋巴瘤患者的无进展生存期和总体生存期
核心数据揭秘:EPCORE NHL-1的2年随访奇迹
• 高应答率与深度缓解:
ORR为 63.1%,其中部分缓解(PR)为22.9% (36/157) 。
CRR达到 40.1%,中位CR时间为2.6个月,大多数患者在第6周或第12周实现CR。
• 持久疗效与长期生存:
在达到完全缓解的患者中,估计有64.2%的人在24个月时仍保持完全缓解状态。这表明一旦起效,疗效非常持久。
对于所有患者,中位OS达到18.5个月,显著优于历史数据。
尤其是在完全缓解者中,估计的24个月PFS率高达65.1%,24个月总生存率高达78.2%,意味着绝大多数获得深度缓解的患者能够长期生存。
• 微小残留病(MRD)阴性:预测疗效的“金标准”
在119位可评估MRD的患者中,45.4%达到了MRD阴性。
MRD阴性患者拥有显著更长的无进展生存期和总生存期,这证实了MRD是预测长期疗效的强大生物标志物。
MRD阴性患者的24个月OS率高达77.7%,与完全缓解者的OS率接近。
• 广泛人群受益:
在不同高危亚组中,Epcoritamab均显示出一致的完全缓解率:
▪ 既往接受过CAR-T治疗的患者:36%
▪ 原发难治性疾病患者:32%
▪ 国际预后指数(IPI)≥3的高危患者:37%
安全性分析:毒性可控,主要不良事件符合双抗药物的已知特征。
❷Glofitamab(格菲妥单抗)[3]
Glofitamab(格菲妥单抗)也是CD20xCD3双特异性抗体,由罗氏(Roche)开发,其上市批准主要基于一项关键临床研究——NP30179,该研究为一项I/II期、多中心、开放标签的临床试验。
根据NP30179研究数据:在入组的155例重度经治R/R LBCL患者中,85.1%对末线治疗无效,33.1%曾接受过CAR-T治疗。
疗效方面,格菲妥单抗展现出显著且持久的抗肿瘤活性:CRR达40.0%(62/155),ORR为51.6%(80/155),中位随访13.4个月时,73.1%的完全缓解者在12个月时仍维持缓解,中位缓解持续时间达18.4个月。
早期分析显示,治疗结束后12个月时61%的完全缓解患者仍处于CR状态,92.6%患者无疾病进展,仅1例出现进展。安全性上,最常见不良事件为细胞因子释放综合征(CRS),主要为1-2级(1级48.1%,2级12.3%),3级及以上发生率为3.9%,仅1例患者因CRS停药。
❸Mosunetuzumab(莫妥珠单抗)[4]
不同于前两者主要针对弥漫大B细胞淋巴瘤,莫妥珠单抗在复发/难治性滤泡性淋巴瘤(R/R FL)这一惰性亚型中展现了卓越的疗效。
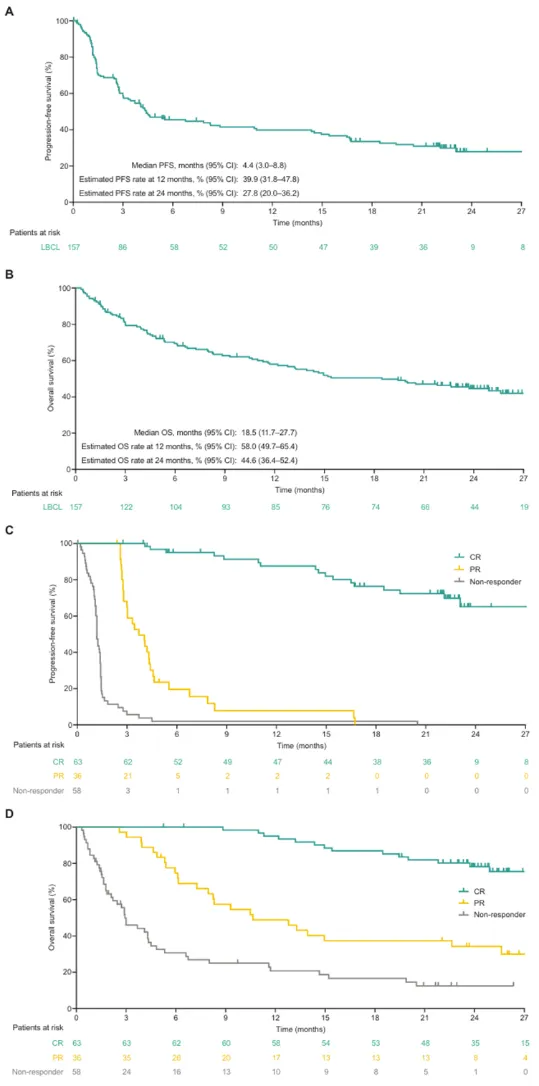
今年,《Blood》杂志发表了关于莫妥珠单抗关键性I/II期研究(NCT02500407)的长期3年随访数据,该研究纳入了90例既往接受过至少2线全身治疗的R/R FL患者,这些患者接受了固定疗程的莫妥珠单抗治疗(最长17个周期)。
关键疗效数据:
经过长达37.4个月的中位随访,莫妥珠单抗在R/R FL患者中展现出深刻且持久的疗效(如下表):其ORR高达77.8%,其中,有60%的患者达到了CR,DOR长达35.9个月。在达到CR的患者中,其中位缓解持续时间尚未达到。此外,该疗法显著控制了疾病进展,中位PFS为24.0个月,36个月OS率高达82.4%。
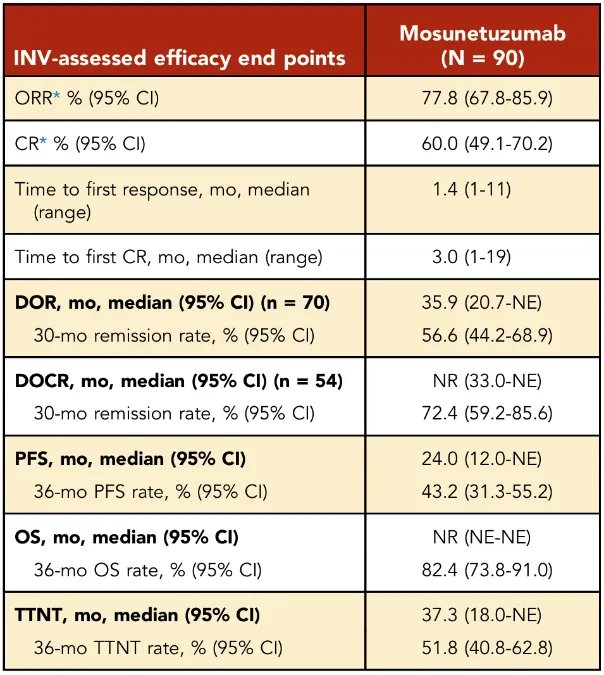
莫妥珠单抗在总体人群中的疗效总结
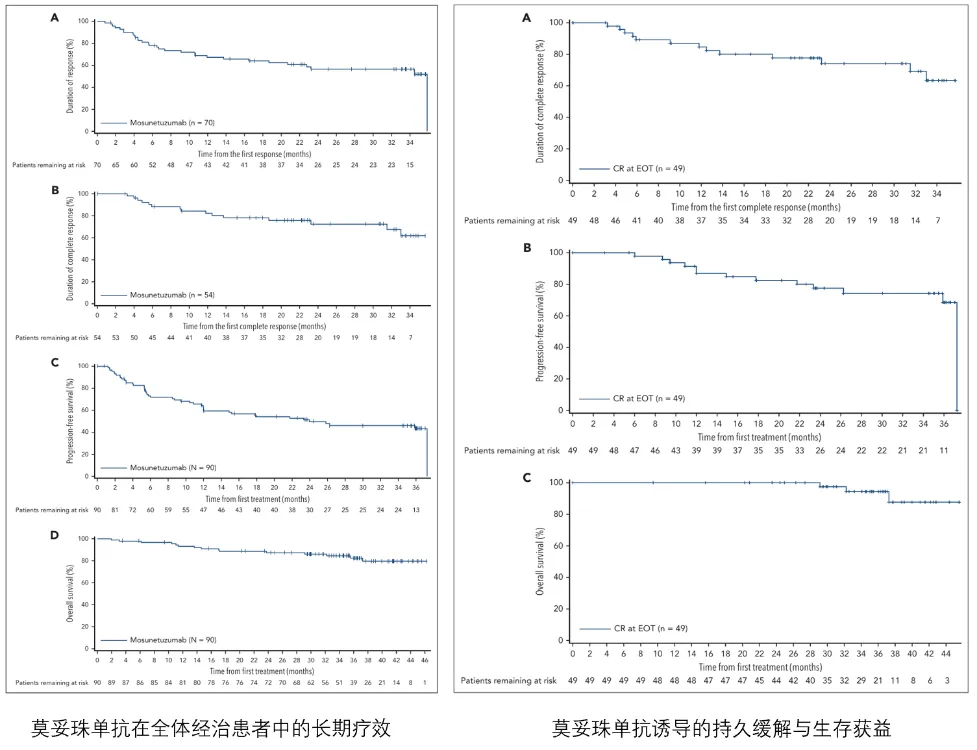
在延长的随访期内,莫妥珠单抗的安全性持续可控,未报告新的CRS事件,也未报告新的致命性、严重性或3级不良事件。
总的来说,双特异性抗体疗法展现了良好的治疗潜力,能为患者带来较高ORR,其中部分患者甚至可获得长期缓解。
在便利性方面,其给药方式友好(尤其是皮下制剂),多数治疗可在门诊完成,极大减轻了患者负担。尽管可能引发CRS这一典型副作用,但该反应通常可控。对于不适合CAR-T、或CAR-T后复发的患者,双特异性抗体疗法提供了新希望。
五、CAR-T:让身体的免疫细胞“重新编程”去杀肿瘤
CAR-T 是近几年最具革命性的治疗方式。它利用现代基因工程技术,把患者自身的T细胞“重新武装”,让它们变成对肿瘤更具杀伤力的“特种兵”——然后再输回体内去追杀肿瘤。让我们一起对目前国际上主要CAR-T产品及效果进行速览:
❶Axi-cel(ZUMA-1研究)[5]
ZUMA-1是一项关键性、多中心、单臂临床试验,旨在评估一种靶向CD19的自体CAR-T细胞疗法(axicabtagene ciloleucel, axi-cel)在难治性大B细胞淋巴瘤(LBCL)患者中的疗效与安全性。2023年5月,《血液》(Blood)杂志发布了该研究的五年随访结果,这也是目前CAR-T疗法在LBCL领域中随访时间最长的数据之一。
• 治疗方案:接受淋巴清除化疗后,单次静脉输注Axi-cel(目标剂量:2 x106 CAR T细胞/kg体重)。
• 研究人群:接受治疗的患者共101例。
• 中位年龄:58岁(23–76岁)
• 疾病类型:弥漫性大B细胞淋巴瘤:76%,原发性纵隔B细胞淋巴瘤:8%,转化性滤泡性淋巴瘤:16%
• 既往治疗:89%患者接受过铂类化疗,25%患者接受过自体干细胞移植
• 中位随访时间:63.1个月。
核心疗效结果:5年长期随访数据
该研究随访数据表明,axi-cel在难治性LBCL患者中展现出显著长期疗效。ORR高达83%,其中58%的患者实现了CR。
尤为引人注目的是其生存数据:所有接受治疗患者的中位总生存期达到25.8个月,五年OS率预估为42.6%。如果只考虑与淋巴瘤相关的死亡,五年疾病特异性生存率则达到了51.0%。有31%的患者在五年时仍保持缓解状态,且其中30%为深度完全的持续缓解。
此外,在获得完全缓解的患者群体中,五年生存率高达64.4%。这清晰地表明,一旦通过axi-cel达到深度缓解,患者就有很大机会获得长期生存,甚至可能走向临床治愈。
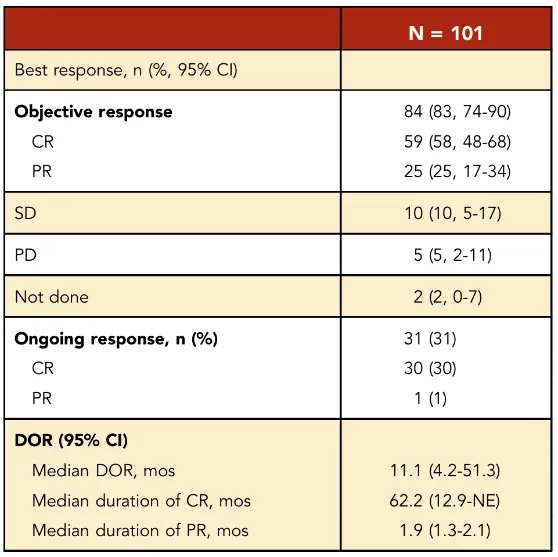
疗效响应情况
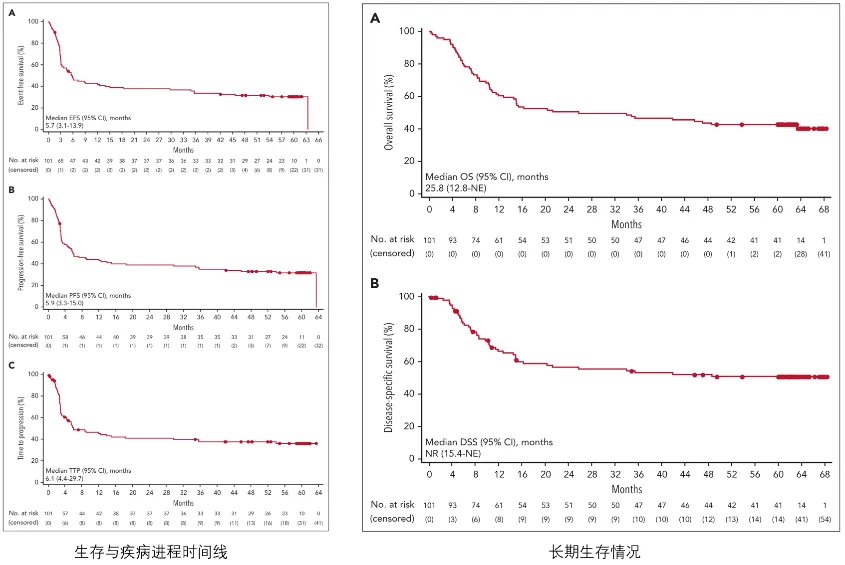
❷Tisa-cel(JULIET研究)[6]
JULIET研究是一项多中心、开放标签、单臂的II期临床试验,旨在评估靶向CD19的CAR-T细胞疗法——Tisa-cel(tisagenlecleucel)在R/R LBCL成人患者中的疗效与安全性。在全球10个国家/地区(包括美国、加拿大、德国、日本等)的27个治疗中心开展,共入组了115名患者。这些患者的情况非常严峻:
• 病情严重:90%的患者对最后一次治疗无效(难治性),所有患者均曾接受过包括利妥昔单抗和蒽环类药物在内的至少二线治疗。
• 高龄与高危:中位年龄为56岁,23%的患者年龄≥65岁,57%的患者在入组时已是疾病IV期,73%的患者在研究开始时的国际预后指数(IPI)大于等于2。
• 经过多线治疗:患者既往接受过中位3线治疗,44%的患者甚至接受过自体干细胞移植。
核心疗效结果:40.3个月的持久活性
经过超过三年的中位随访,JULIET研究证实Tisa-cel在R/R LBCL患者中能诱导深度且持久的缓解。
数据显示,患者的最佳ORR高达53.0%,其中39%的患者达到了CR。疗效显示出卓越的持久性,在获得缓解的患者中,有60.4%的人在三年后仍维持缓解,其DOR未达到。
这背后的关键驱动力在于实现完全缓解——无论是输注后3个月还是6个月达到CR的患者,他们的中位OS和PFS均未达到,预示着其中大部分患者有望获得长期生存,乃至临床治愈。
此外,研究还观察到晚期转化现象:有部分患者在3个月时评估仅为部分缓解或疾病稳定,却在后续(甚至超过12个月)神奇地转化为完全缓解。
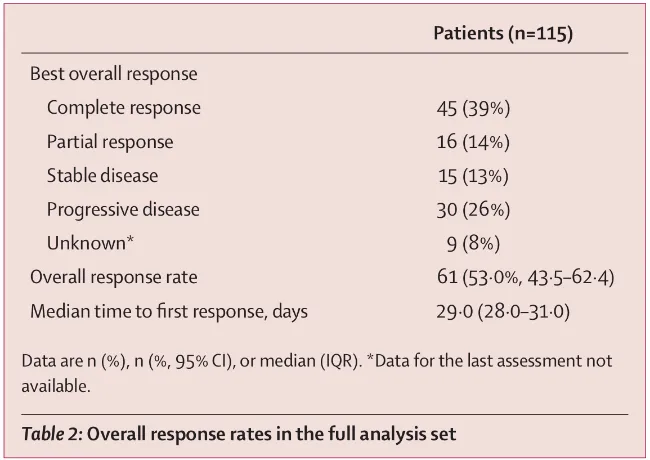
全部患者总体反应率
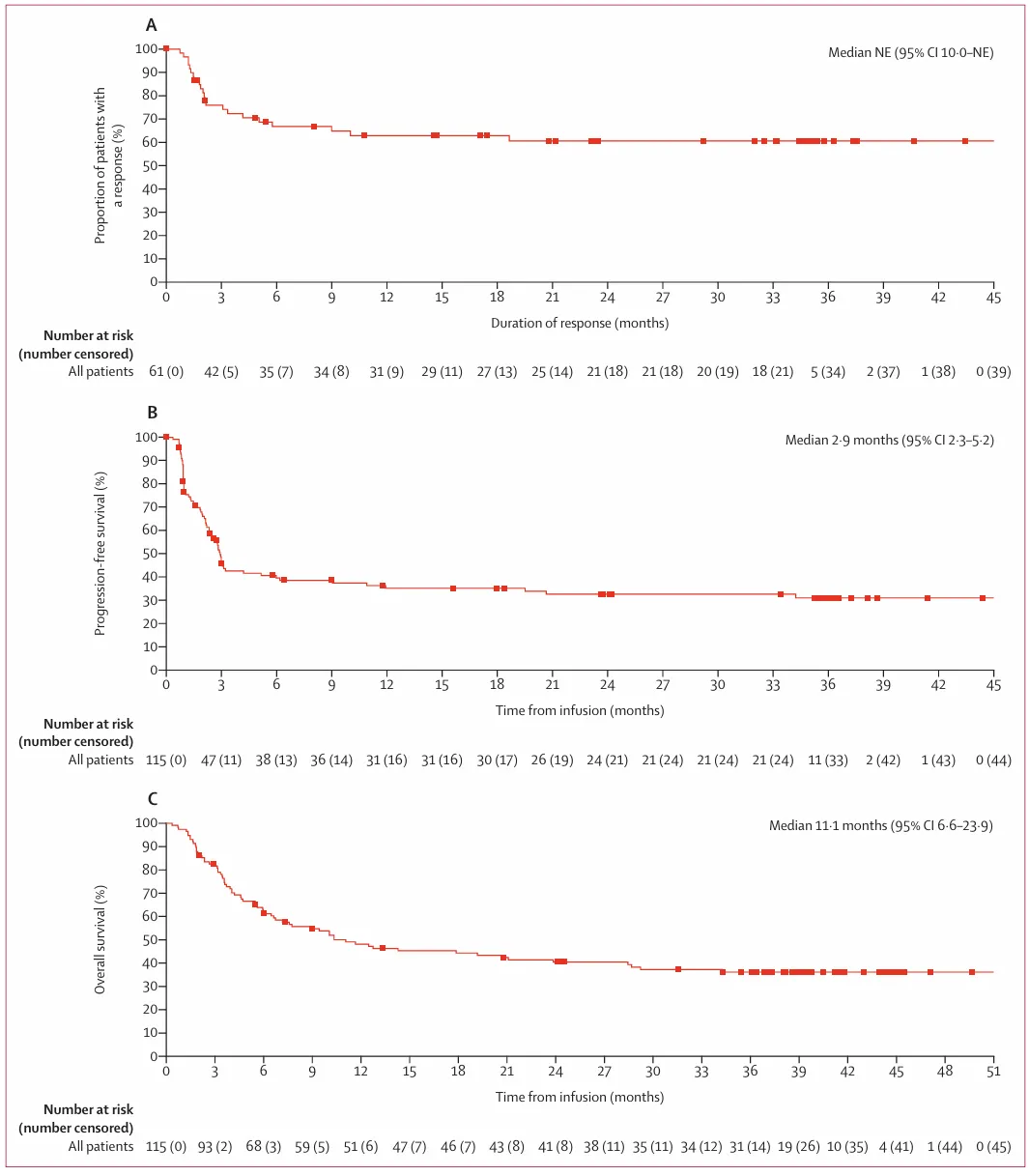
Kaplan–Meier结果估计 (A) 反应持续时间。 (B) 无进展生存期。 (C) 总生存期。
在长期随访中,Tisa-cel的安全性持续可控,且未观察到与Tisa-cel相关的死亡事件。这项研究进一步巩固了CAR-T细胞疗法在R/R LBCL治疗中的地位。
❸Liso-cel(TRANSCEND研究)[7]
2024年发表于《Blood》杂志的 TRANSCEND NHL 001研究两年随访结果全面评估了CD19靶向CAR-T疗法Liso-cel(lisocabtagene maraleucel) 的长期表现。数据显示,这款疗法在为患者带来深度、持久缓解的同时,展现出独特且可控的安全性特征,为预后极差的患者群体提供了强有力的新选择。
TRANSCEND研究是迄今为止在R/R LBCL领域规模最大的CAR-T临床研究,纳入了270名接受liso-cel输注的患者的数据进行分析,精准反映了真实世界中的治疗挑战:
● 高龄患者多:中位年龄高达63岁,41%的患者年龄≥65岁,10%的患者≥75岁。
● 病情极度高危:67% 的患者对既往化疗无效,44%的患者从未达到过完全缓解。
● 经过多线治疗:患者既往接受过中位3线治疗,45%的患者甚至接受过干细胞移植。
● 疾病类型多样:涵盖了弥漫性大B细胞淋巴瘤、由惰性淋巴瘤转化而来的LBCL、高级别B细胞淋巴瘤(双打击/三打击)等多种高危亚型。
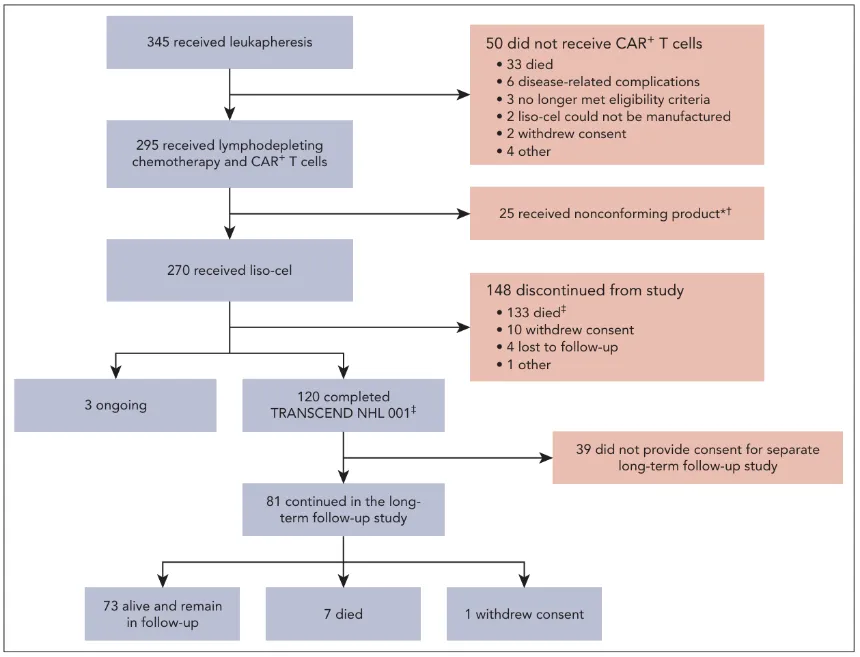
研究流程图
经过近两年的中位随访,TRANSCEND研究证实Liso-cel能为R/R LBCL患者带来深度且持久的缓解。
数据显示,患者的ORR高达73%,其中53%的患者达到了CR。疗效的持久性尤为突出,DOR达到23.1个月,且在获得缓解的患者中,有49.5%的人在两年后仍维持缓解。
这直接转化为显著的生存获益:所有接受治疗患者的中位OS延长至27.3个月,两年总生存率达到50.5%,远超传统治疗。
其中,达到CR的患者中位OS长达48.5个月(超过4年),DOR也达到26.1个月,预示着他们有极大机会获得长期疾病控制,乃至走向临床治愈。
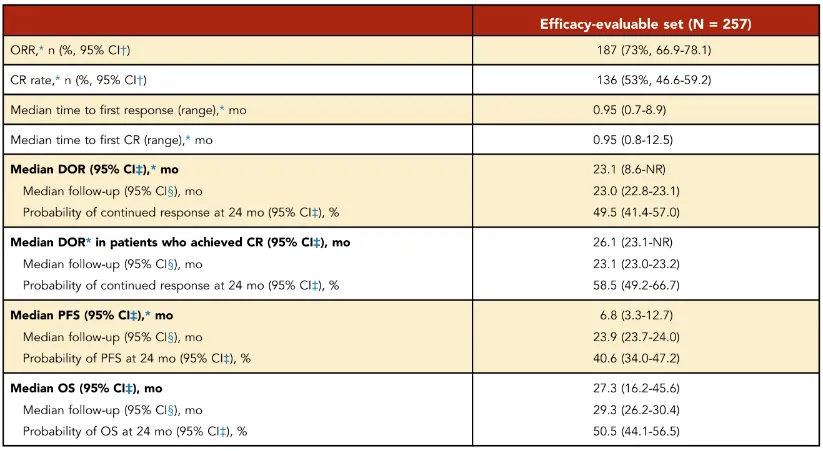
疗效总结
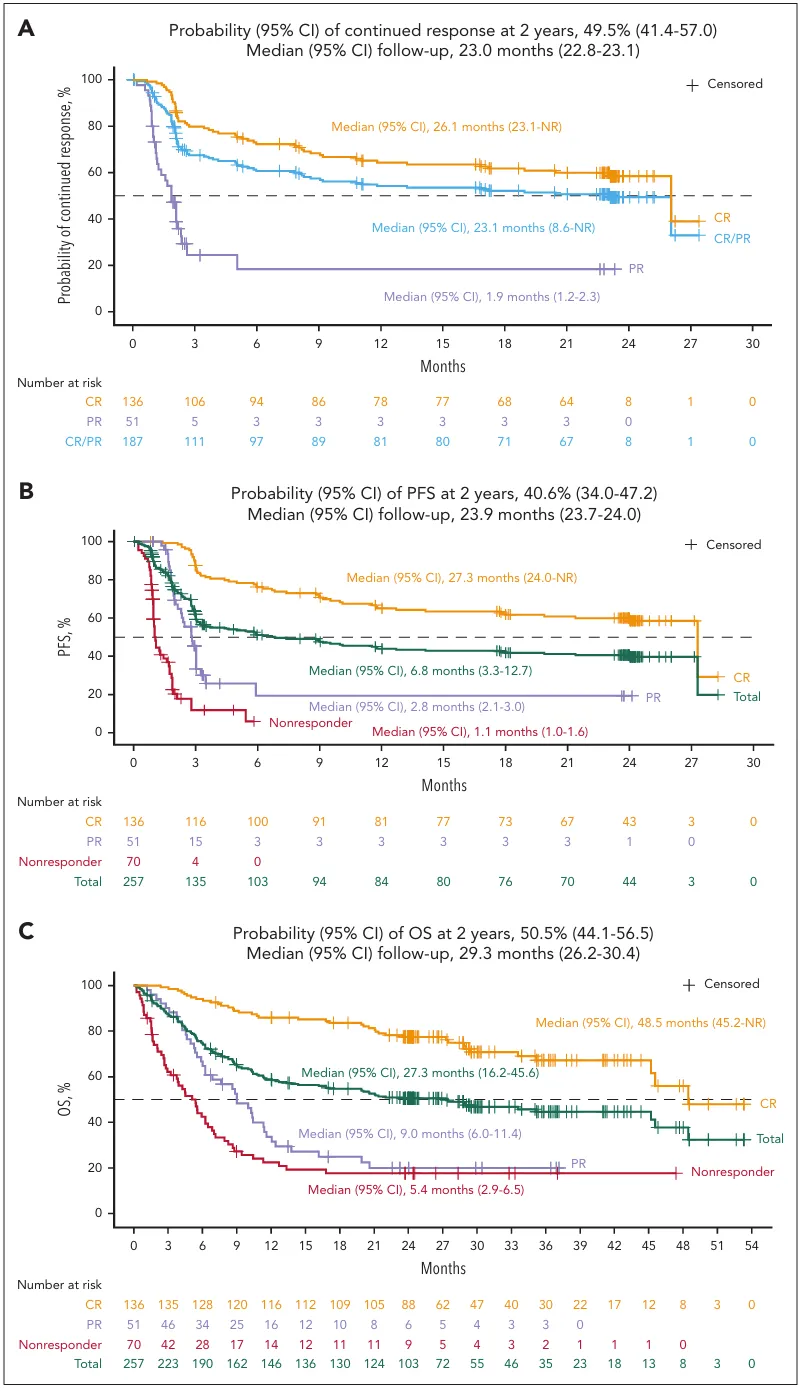
患者生存时间线
liso-cel在长期随访中保持了其标志性的良好安全性,未出现新的安全信号。
综上,CAR-T细胞疗法在治疗难治性血液肿瘤中展现出卓越的疗效,尤其能实现较高的CRR,并为部分患者带来长期生存甚至治愈的希望。
然而,这种前沿治疗也伴随着显著的挑战:其生产过程复杂、制备周期较长,且治疗费用较为高昂;同时,CRS和神经毒性等独特副作用也较为常见,通常需要在具备监护条件的医疗中心进行。综合来看,CAR-T疗法更适合对迅速控制肿瘤有迫切需求的特定患者群体。
六、抗体偶联药物(ADC)与单抗联合:副作用更小的“精准化疗”
ADC药物是一类把“化疗药物”绑在“抗体”上,只把药物送到肿瘤细胞那里,让正常细胞少受牵连的药物。Polatuzumab Vedotin (Pola)就是一种ADC,它能精准识别并结合在B细胞淋巴瘤表面高度特异性的蛋白——CD79b,当结合到癌细胞上后,整个ADC会被“吞”进细胞内部,随后释放携带的强效化疗药(MMAE),从内部精准地杀死癌细胞。
一项发表在《Journal of Clinical Oncology》的随机对照临床试验结果显示[8],在标准BR(苯达莫司汀+利妥昔单抗)方案中加入Pola后组成的Pola-BR方案,能显著提高完全缓解率,并大幅延长患者的PFS和OS,使死亡风险降低近6成。
这是一项国际多中心、开放标签的Ib/II期临床研究。
• 研究分组:
实验组(Pola-BR):Pola+苯达莫司汀+利妥昔单抗
对照组(BR):苯达莫司汀+利妥昔单抗
• 患者:共80例不适合移植的R/R DLBCL患者,1:1随机分配到两组。
主要研究结果:疗效显著提升
截至中位随访22.3个月时,数据呈现出显著差异:
• 完全缓解率:Pola-BR组高达 40%,而BR组仅为 17.5%。
• Pola-BR组中位无进展生存期为 9.5个月,而BR组仅为 3.7个月。
• 与BR相比,Pola-BR将疾病进展或死亡风险显著降低了 64%。
• Pola-BR组中位总生存期为 12.4个月,而BR组仅为 4.7个月。
• 与BR相比,Pola-BR将死亡风险显著降低了 58%!
这是首个在不适合移植的R/R DLBCL患者中,通过随机对照研究证明能显著改善总生存期的治疗方案。
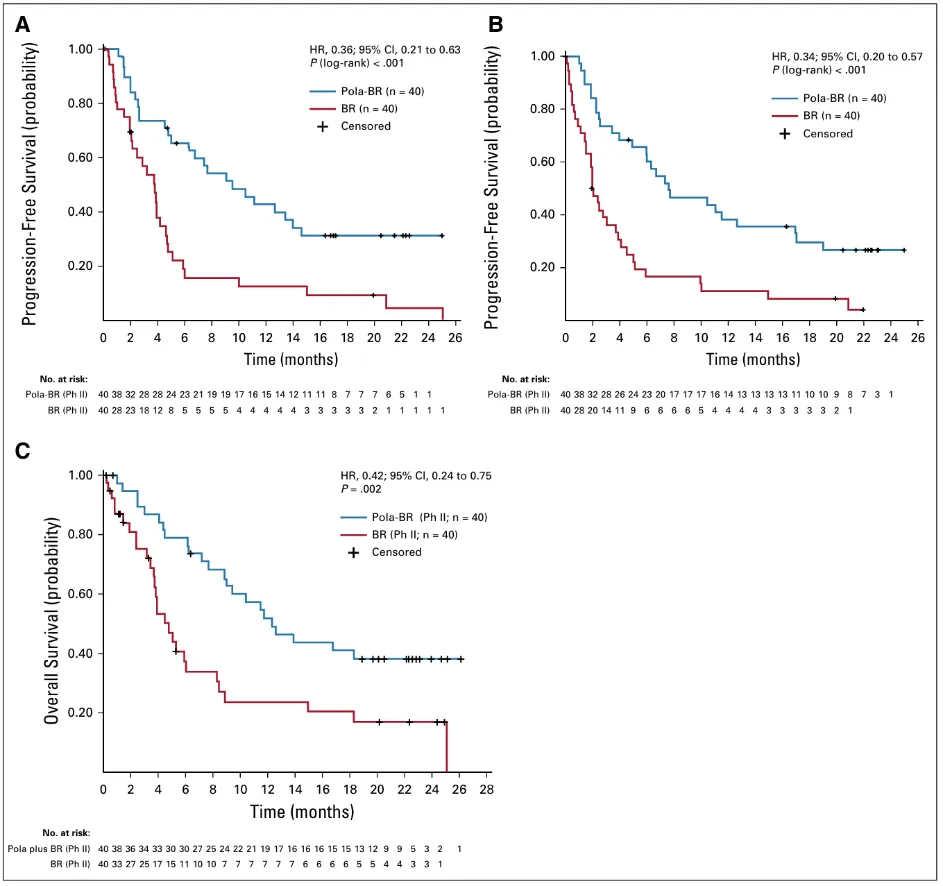
Pola-BR 对比 BR:无进展生存期与总生存期疗效
亚组分析显示广泛受益:无论年龄、性别、既往治疗线数、是否难治、细胞起源分型,几乎所有亚组患者都能从Pola-BR治疗方案中获益。
联合方案的安全性整体可控,不良反应与各药物已知特性一致,未发现新的安全信号。
Pola-BR方案为不适合移植的R/R DLBCL患者提供了一个明确有效、生存获益显著的新选择,已成为国内外指南推荐的标准方案之一。该方案的高缓解率和深度缓解,可能为患者后续接受诸如CAR-T细胞治疗等疗法创造条件和宝贵时间。
七、治疗越走越丰富,选择也越来越多
通过对以上临床试验结果的总结,用一个表格快速理解差异:
治疗方式 | 优点 | 不足 |
双特异性抗体 | 高效、起效快 “现货型”,可及性强 门诊给药,方便管理 | CRS、免疫毒性 缓解持久性待验证 (长期缓解数据不如CAR-T成熟) |
CAR-T | 长期缓解率高 | 制备慢、费用高、对患者体能要求高 |
ADC/单抗 | 副作用相对温和 给药方案灵活 | 深度缓解率略低 通常需要持续治疗 |
过去,复发/难治性淋巴瘤的可选治疗手段有限,很多患者面临不知如何选择的困境。但现在,随着免疫治疗的迅速发展:
• 多款双抗已逐步在世界范围获批
• CAR-T越来越成熟并可获得长期缓解
• ADC和单抗联合方案安全性更佳
不同身体条件、不同病情阶段的患者,都能找到适合自己的治疗方式。医学在进步,治疗也在不断增加。希望每位患者都能找到属于自己的光。
现有多项淋巴瘤临床试验正在各大医院招募肿瘤患者,欢迎咨询!

项目 | 靶点 | 适应症 | 要求 |
MSLN-CAR-T | CAR-T疗法 | 原发弥漫大B淋巴瘤/滤泡淋巴瘤/滤泡转弥漫大B淋巴瘤/套细胞淋巴瘤 | ≥18岁,二线治疗失败的患者 |
GLB-002 | IKZF1/3 分子胶降解剂 | 非霍奇金淋巴瘤 | ≥18 岁,标准治疗失败 |
APG-2575联合阿可替尼 | Bcl-2抑制剂 | 慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 | ≥18,初治 |
ICP-248联合奥布替尼 | Bcl-2抑制剂 | 慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 | 18~80岁,初治 |
奥布替尼+苯达莫司汀+利妥昔 | BTK抑制剂 | 套细胞淋巴瘤 | ≥60岁,初治 |
PA3-17 | CAR-T疗法 | CD7阳性的T急淋和T淋母 | 18-70 岁,标准治疗失败 |
RJMty19 | 通用型CD19-CAR-DNT | 非霍奇金淋巴瘤 | 18~65,标准治疗失败 |
BEBT-908 联合利妥昔单抗 | 双靶点抑制剂 | 弥漫大B细胞淋巴瘤 | 18~75,标准治疗失败 |
XNW5004 | EZH2抑制剂 | 外周T细胞淋巴瘤 | 18~70岁,接受过至少一种系统治疗 |
SepantroniumBromide(PC-002)联合利妥昔单抗 | DUB抑制剂 | 伯基特淋巴瘤+弥漫大B | ≥18岁,标准治疗失败 |
B019注射液 | CAR-T疗法 | 弥漫大B非霍奇金淋巴瘤 | 18-70 岁,标准治疗失败 |
IM19 CAR-T | CAR-T疗法 | 套细胞淋巴瘤 | ≥18岁,至少二线失败 |
LV009 | 体内CAR-T疗法 | B细胞淋巴瘤、白血病 | 18-70 岁,符合复发/难治的标准 |
克耐替尼 | EGFR、BTK双靶点靶向药 | 套细胞淋巴瘤、慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL) | ≥18 岁,标准治疗失败 |
迪诺仑赛注射液 | CAR-T疗法 | 弥漫大B淋巴瘤 | ≥18岁,至少二线治疗后 |
凯石招募——临床试验招募平台
参与临床试验的患者,可以免费用试验新药,与试验相关的检查也是免费的。
目前有CAR-T、TIL等细胞疗法,PD-1/PD-L1等免疫治疗药物,小分子抑制剂、双抗、单抗、ADC等靶向药物的临床试验正在进行中。
正在招募肺癌、食管癌、肝癌、胃癌、结直肠癌、宫颈癌、卵巢癌、乳腺癌、胆管癌、子宫内膜癌、黑色素瘤、肉瘤、恶性血液疾病、淋巴瘤等各种恶性肿瘤,想要了解或者参加临床试验项目,可以咨询我们医学部的老师。

参考文献:
[1]Tuscano JM, Othman T, Frankel P PhD, et al. A Phase I Study of Blinatumomab/Lenalidomide in Relapsed/Refractory B cell Lymphoma; Toxicity, Efficacy and Correlative Analysis. Blood Adv. Published online November 10, 2025.
[2] Thieblemont C, Karimi YH, Ghesquieres H, et al. Epcoritamab in relapsed/refractory large B-cell lymphoma: 2-year follow-up from the pivotal EPCORE NHL-1 trial. Leukemia. 2024;38(12):2653-2662.
[3] FDA grants priority review to Roche’s bispecific antibody glofitamab for people with relapsed or refractory large B-cell lymphoma. Roche Media Release. January 06, 2023.
[4] Sehn, Laurie H et al. “Long-term 3-year follow-up of mosunetuzumab in relapsed or refractory follicular lymphoma after ≥2 prior therapies.” Blood vol. 145,7 (2025): 708-719.
[5] Neelapu, Sattva S et al. “Five-year follow-up of ZUMA-1 supports the curative potential of axicabtagene ciloleucel in refractory large B-cell lymphoma.” Blood vol. 141,19 (2023): 2307-2315.
[6] Schuster, Stephen J et al. “Long-term clinical outcomes of tisagenlecleucel in patients with relapsed or refractory aggressive B-cell lymphomas (JULIET): a multicentre, open-label, single-arm, phase 2 study.” The Lancet. Oncology vol. 22,10 (2021): 1403-1415.
[7] Abramson, Jeremy S et al. “Two-year follow-up of lisocabtagene maraleucel in relapsed or refractory large B-cell lymphoma in TRANSCEND NHL 001.” Blood vol. 143,5 (2024): 404-416.
[8] Sehn, Laurie H et al. “Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma.” Journal of clinical oncology : official journal of the American Society of Clinical Oncology vol. 38,2 (2020): 155-165.