双免疫+化疗攻克晚期胃/食管癌,中位生存期 26.7 个月(近翻倍),PD-L1 高表达者获益更显著
导语: 在晚期胃腺癌(GC)、胃食管结合部癌(GEJC)及食管腺癌(EAC)治疗领域,PD-1 抑制剂联合化疗虽已成为一线标准,但患者中位总生存期(OS)仍难突破 15 个月,且近半数患者无法从中获益。
如今,这一困境被国际多中心 II 期试验 “EDGE-Gastric” 打破 —— 该研究近日发表于《Nature Medicine》(IF=82.9)的“Domvanalimab and zimberelimab in advanced gastric, gastroesophageal junction or esophageal cancer: a phase 2 trial”,证实TIGIT 抑制剂 domvanalimab 联合 PD-1 抑制剂 zimberelimab + 化疗(FOLFOX) ,为晚期 HER2 阴性胃 / 食管相关癌患者带来 “疗效翻倍” 的突破,中位 OS 达 26.7 个月,PD-L1 高表达者甚至未达到中位 OS,相关方案已推进至 III 期临床试验(STAR-221)!
一、试验背景:为何选择“TIGIT+PD-1” 双免疫联合?
晚期胃 / 食管相关癌的免疫治疗长期面临 “两大瓶颈”:一是单药 PD-1 抑制剂响应率低(仅 15%-20%),二是联合化疗后仍有近 40% 患者快速进展。而 TIGIT 作为免疫检查点家族的 “新靶点”,与 PD-1 存在 “协同抑制” 机制:
TIGIT 机制:表达于激活的 T 细胞和 NK 细胞表面,通过竞争性结合配体 CD155,抑制免疫细胞活化,且其表达与 PD-1 高度重叠,尤其在肿瘤浸润 T 细胞中;
双靶点协同优势:PD-1 通路负责 “解除 T 细胞抑制”,TIGIT 通路负责 “增强 T 细胞活化信号”,二者联合可激活更广泛的抗肿瘤免疫应答,且化疗(FOLFOX)能进一步 “释放肿瘤抗原”,三者协同形成 “1+1+1>3” 的疗效放大效应。
本次EDGE-Gastric试验选择的domvanalimab(抗 TIGIT)还具备独特优势 —— 采用 “Fc 沉默设计”,可避免诱导抗体依赖性细胞毒性(ADCC),减少外周调节性 T 细胞(Tregs)耗竭,从而降低免疫相关不良反应(irAEs)发生率,这也是其安全性优于其他 TIGIT 抑制剂的核心原因。
二、试验设计:国际多中心 II 期,聚焦 HER2 阴性一线患者
EDGE-Gastric 试验(NCT05329766)是一项开放标签、多中心、国际 II 期研究,共设 3 个队列,本次重点解析 “一线治疗队列 A1”,其设计细节对临床研究人员极具参考价值:
1. 入组人群:精准锁定难治性患者
核心标准:经病理证实的晚期 HER2 阴性 GC/GEJC/EAC,包括局部晚期不可切除或转移性患者;ECOG PS 评分 0-1 分;未接受过针对晚期疾病的系统性治疗;排除合并中枢神经系统转移者。
人群特征:2022 年 8 月 - 2023 年 3 月,全球 20 个中心(美国、法国、韩国)共入组 41 例患者,中位年龄 62 岁(30-82 岁),男性占 59%;其中 GC 占 63%、GEJC 占 12%、EAC 占 24%;IV 期患者占 95%(IVB 期 71%),44% 合并腹膜转移、29% 合并肝转移(均为预后差的高危因素);PD-L1 阳性(TAP≥1%)患者占 71%,高表达(TAP≥5%)占 39%。
2. 治疗方案:双免疫 + 化疗的精准剂量与周期
药物组合:domvanalimab(1600mg,静脉输注,每 4 周 1 次)+ zimberelimab(480mg,静脉输注,每 4 周 1 次)+ FOLFOX 化疗(奥沙利铂 85mg/m²,亚叶酸钙 400mg/m²,氟尿嘧啶 400mg/m² 第 1 天推注 + 2400mg/m² 第 1-2 天持续 46-48 小时输注,每 2 周 1 次)。
治疗周期:持续治疗至疾病进展、出现不可耐受毒性、患者撤回知情同意,或完成 2 年最大治疗周期(无论是否进展,若临床获益可继续)。
3. 核心终点:聚焦 “疗效深度” 与 “生存时长”
主要终点:客观缓解率(ORR,RECIST v1.1 标准)与安全性;
次要终点:中位无进展生存期(PFS)、中位 OS、疾病控制率(DCR)、缓解持续时间(DOR),及不同 PD-L1 表达亚组的疗效差异。
三、临床数据:三大核心指标全面突破,PD-L1 高表达者获益 “翻倍”
经过中位 26.4 个月的随访,该方案展现出 “高响应率、长缓解期、长生存” 的三重优势,且疗效随 PD-L1 表达水平升高而显著提升,具体数据如下:
1. 整体疗效:ORR 59%,中位 OS 近 27 个月
缓解率:41 例患者中,确认 ORR 达 59%(90% CI 44.5%-71.6%),包括 3 例完全缓解(CR,7%)和 21 例部分缓解(PR,51%);疾病控制率(DCR)高达 93%,仅 2 例(5%)出现疾病进展;
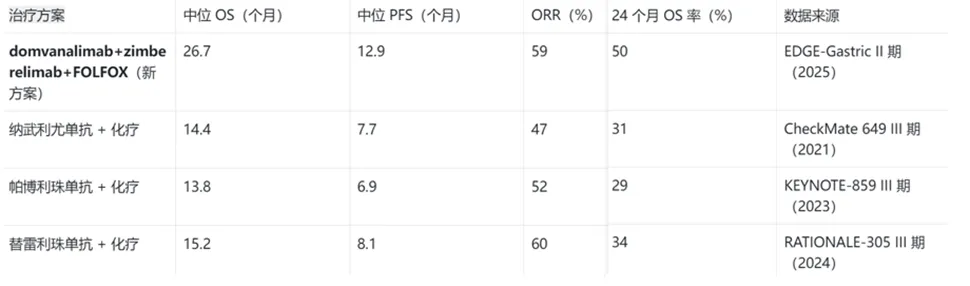
生存时长:中位 PFS 为 12.9 个月(90% CI 9.8-14.6 个月),24 个月 PFS 率 26%;中位 OS 达 26.7 个月(90% CI 18.4 个月 - 未达到),24 个月 OS 率 50%—— 这意味着半数患者存活超过 2 年,较传统 PD-1 + 化疗方案(中位 OS 12-14 个月)提升近 1 倍;
缓解持续性:24 例响应患者的中位 DOR 为 12.4 个月(90% CI 10.2-15.4 个月),其中 11 例(46%)缓解持续超过 18 个月,展现出 “长期获益” 特征。
2. PD-L1 亚组:高表达者疗效 “再升级”,中位 OS 未达到
试验进一步证实,PD-L1 表达水平是疗效的核心预测因子,TAP≥5%(PD-L1 高表达)患者获益最为显著:
ORR 差异:TAP≥1% 组 ORR 62%(18/29),TAP≥5% 组 ORR 升至 69%(11/16),而 TAP<1% 组仅 46%(5/11);
生存差异:TAP≥1% 组中位 OS 26.7 个月(90% CI 19.5 个月 - 未达到),24 个月 OS 率 54%;TAP≥5% 组中位 OS “未达到”(90% CI 17.4 个月 - 未达到),24 个月 OS 率 56%;TAP<1% 组中位 OS 仅 18.4 个月,24 个月 OS 率 33%;
PFS 与 DOR:TAP≥5% 组中位 PFS 14.5 个月(90% CI 11.3 个月 - 未达到),中位 DOR 15.4 个月,均显著优于低表达组(TAP<5% 组中位 PFS 11.3 个月、中位 DOR 10.9 个月)。
3. 安全性:无新增毒性,免疫相关不良反应发生率低
尽管是“双免疫 + 化疗” 三联方案,但其安全性与传统 PD-1 + 化疗相当,未出现预期外毒性:
整体不良反应(TEAE):100% 患者出现 TEAE,73% 为≥3 级 TEAE,最常见为恶心(59%)、中性粒细胞计数降低(44%)、贫血(17%),多与化疗相关;
免疫相关不良反应(irAEs):仅 27% 患者出现 irAEs,以甲状腺功能减退(12%)、肾上腺功能不全(5%)、肺炎(5%)为主,且无≥3 级 irAEs,显著低于其他 TIGIT 抑制剂联合方案(传统方案 irAEs 发生率约 40%-50%);
治疗中断率:仅 10%(4/41)患者因不良反应停用双免疫药物,无治疗相关死亡,提示该方案 “高效且耐受”,适合长期使用。
四、与标准方案对比:全面超越
五、临床意义与未来方向
1.III 期试验启动:STAR-221 试验(NCT05568095)计划入组 800 例患者,头对头对比新方案与 “纳武利尤单抗 + 化疗”,预计 2027 年出结果,成功后有望改写指南;
2.精准筛选:VENTANA SP263 assay(TAP 评分)可快速识别获益人群,TAP≥5% 患者优先推荐;
3.药物设计亮点:domvanalimab 的 “Fc 沉默设计” 降低 irAEs 发生率,为 TIGIT 抑制剂研发提供参考。
现有多项胃癌临床试验正在各大医院招募受试者,欢迎咨询!

凯石招募——临床试验招募平台
参与临床试验的患者,可以免费用试验新药,与试验相关的检查也是免费的。
目前有CAR-T、TIL等细胞疗法,PD-1/PD-L1等免疫治疗药物,小分子抑制剂、双抗、单抗、ADC等靶向药物的临床试验正在进行中。
正在招募肺癌、食管癌、肝癌、胃癌、结直肠癌、宫颈癌、卵巢癌、乳腺癌、胆管癌、子宫内膜癌、黑色素瘤、肉瘤、恶性血液疾病、淋巴瘤等各种恶性肿瘤,想要了解或者参加临床试验项目,可以咨询我们医学部的老师。


原文链接:
https://www.nature.com/articles/s41591-025-04022-w